
分析 6g有机物为0.1mol,完全燃烧生成6.72L(标准状况)CO2物质的量为$\frac{6.72L}{22/4L/mol}$=0.3mol,生成的7.2g H2O的物质的量为$\frac{7.2g}{18g/mol}$=0.4mol.根据原子守恒计算有机物分子中C、H原子数目,再结合有机物的相对分子质量计算有机物分子中氧原子数目,进而确定有机物的分子式,能与钠反应,则含有羟基或羧基,以此解答该题.
解答 解:(1)6g有机物为0.1mol,完全燃烧生成6.72L(标准状况)CO2物质的量为$\frac{6.72L}{22/4L/mol}$=0.3mol,生成的7.2g H2O的物质的量为$\frac{7.2g}{18g/mol}$=0.4mol,则有机物含有3个C、8个H,且N(O)=$\frac{60-3×12-8}{16}$=1,所以分子式为C3H8O,故答案为:C3H8O;
(2)能与钠反应说明含有羟基,可能的结构简式为CH3 CH2CH2OH 或CH3 CH (OH) CH3,故答案为:CH3 CH2CH2OH 或CH3 CH (OH) CH3.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,注意掌握燃烧法利用元素原子守恒确定有机物的分子式.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3-O-CH3 | B. | (CH3)3C-CH2-O-CH3 | ||
| C. | (CH3)3C-CH2-O-CH2-C(CH3)3 | D. | (CH3)2C=CH(CH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(b-a)}{V}$ | B. | $\frac{(2b-a)}{V}$ | C. | $\frac{2(b-a)}{V}$ | D. | $\frac{2(2b-a)}{V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
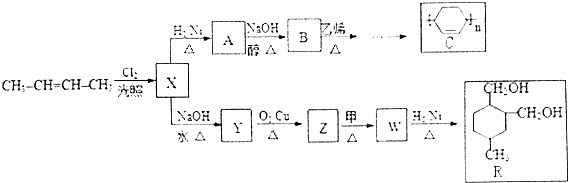
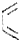 +
+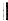 $\stackrel{△}{→}$
$\stackrel{△}{→}$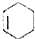
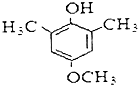 .
.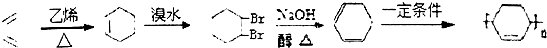 .(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)
.(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
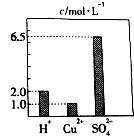 在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题:
在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

组号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/ml | c/mol•L-1 | V/ml | c/mol•L-1 | V/ml | ||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | a |
| C | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为手性异构体的分子互为镜像 | |
| B. | 利用手性催化剂合成可主要得到一种手性分子 | |
| C. | 手性异构体分子组成相同 | |
| D. | 手性异构体性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molNa2O2溶于足量水,电子转移数为NA | |
| B. | 1L0.5mol/L C2H5OH溶液中含有的氢原子数为3NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com