
| A. | 新制氯水中加CaCO3后,溶液漂白性增强 | |
| B. | 盛有NO2、N2O4混合气体的烧瓶置于冰水中,气体颜色变浅 | |
| C. | 反应:H2(g)+I2(g)?2HI(g) 达平衡后,减小气体体积,气体颜色变深 | |
| D. | 恒温等容时,在SO2,O2和SO3的平衡体系中加入氧气,提高SO2的转化率 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.依据氯水中的化学平衡为Cl2+H2O?HCl+HClO,加入碳酸钙和盐酸反应促进平衡正向进行,次氯酸浓度增大,漂白性增强,和平衡有关,能用勒夏特利原理解释,故A不选;
B.二氧化氮和四氧化二氮混合气体的密闭容器置于冷水中,化学平衡向着生成四氧化二氮的方向进行,颜色变浅,能用勒夏特利原理解释,故B不选;
C.氢气与碘蒸气反应的平衡中,前后气体系数和是相等的,压强对平衡无影响,压缩气体,碘单质的浓度增大,颜色加深,不能用勒夏特利原理解释,故C选;
D.恒温等容时,在SO2,O2和SO3的平衡体系中加入氧气,平衡正向移动,可以用平衡移动原理解释,故D不选;
故选C.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
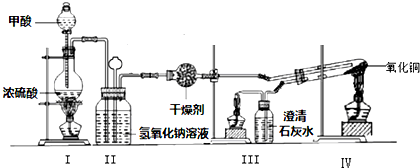
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据其结构判断该含氧酸为强酸 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线形非极性分子 | D. | 该分子的电子式是H:O:Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
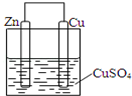 某同学设计的原电池如图所示,回答下列问题:
某同学设计的原电池如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
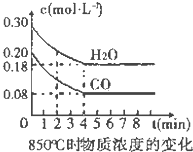 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素均为金属元素 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 含离子键的晶体一定是离子晶体,含共价键的晶体一定是分子晶体 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com