
常温下,两种溶液① 0.1 mol?L-1 NH3·H2O ② 0.1 mol?L-1 NH4Cl中:
(1)溶液①的pH 7(填“>”、“<”或“=”),其原因是: (用电离方程式表示)。
(2)溶液②呈 性(填“酸”、“碱”或“中”)。水解反应是吸热反应,升温可以 (填“促进”或“抑制”)NH4Cl的水解。
(3)下列关于两种溶液中c(NH4+) 的叙述正确的是 (填字母)。
a.两种溶液中c(NH4+) 都等于0.1 mol?L-1
b.两种溶液中c(NH4+) 都小于0.1 mol?L-1
c.NH4Cl溶液中c(NH4+) 小于NH3·H2O溶液中c(NH4+)
(1)>(1分) NH3·H2O  NH4+ +OH- (2分)
NH4+ +OH- (2分)
(2)酸(1分) 促进(1分)
(3)b (1分)
解析试题解析:(1)NH3·H2O是弱碱,其在水中部分电离产生NH4+、OH-,所以pH>7,
(2)NH4Cl溶液中的NH4+水解会使溶液呈酸性,pH<7,水解反应是吸热反应,升温使平衡向吸热反应方向进行,因此会促进NH4Cl的水解。
(3)a、NH3·H2O是弱碱,不完全电离;NH4Cl溶液中NH4+部分水解,所以两种溶液NH4+的浓度均小于0.1mol/l,错误;b、正确;c、两种溶液中NH4+的浓度的大小由电离程度和水解程度的强弱来判断,本题中无法判断,答案选b。
考点:考查溶液的酸碱性、弱电解质的电离、盐的水解、外界条件对平衡的影响


科目:高中化学 来源: 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:CO(g) + 2H2 (g)  CH3OH (g) DH1
CH3OH (g) DH1
反应Ⅱ:CO2(g)+ 3H2(g)  CH3OH (g)+H2O(g) DH2
CH3OH (g)+H2O(g) DH2
① 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO的初始浓度(mol/L) | 2 | 4 | 1 | 3 |
| H2的初始浓度(mol/L) | 3 | 2 | 3 | 3 |
| 时间(min) | 8 | 6 | 12 | n |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在1.0 L密闭容器中放入0.10 mol A (g),在一定温度进行如下反应:A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p /100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
T ℃、2 L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体)。回答下列问题。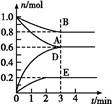
(1)写出该反应的化学方程式: 。
(2)反应开始至3 min时,用D表示的平均反应速率为 mol·L-1·min-1。
(3)T ℃时,该反应的化学平衡常数K= 。
(4)第6 min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为 。
(5)另有一个2 L的密闭容器,T ℃、某一时刻,容器中各物质的物质的量如表所示。
| 物质 | A | B | D | E |
| 物质的量(mol) | 0.8 | 1.0 | 0.4 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。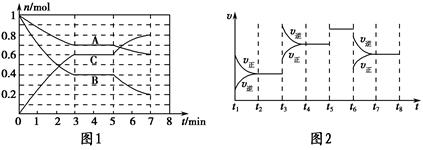
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)(浙江高考)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
(2)(天津高考)写出WO3(s)+3H2(g)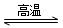 W(s)+3H2O(g)的化学平衡常数表达式为________。
W(s)+3H2O(g)的化学平衡常数表达式为________。
(3)(福建高考)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)??2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:________。
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将水煤气转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域。除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为 。
②下列能增大碳的转化率的措施是 。
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
 CO(g)+2H2O(g) ΔH="-519" kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO(g)+2H2O(g) ΔH="-519" kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O72—和CrO42—,常用的方法有两种。
方法1 还原沉淀法
该法的工艺流程为 。
。
其中第①步存在平衡2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O。
Cr2O72—(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_______________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72—,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):__________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):__________。
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O72—的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是___________________。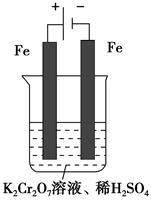
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇被称为2l世纪的新型燃料,工业上通过下列反应I和II,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) 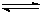 CO(g)+3H2 (g)……I CO(g)+2H2(g)
CO(g)+3H2 (g)……I CO(g)+2H2(g) 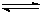 CH3OH(g) ……II。
CH3OH(g) ……II。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。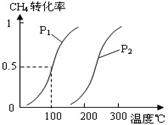
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为____________________。
②图中的P1_________P2(填“<”、“>”或“=”),100℃时平衡常数的值为__________ 。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H ____ 0;若容器容积不变,下列措施可增加甲醇产率的是________。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
| 实验编号 | T(℃) | N(CO)/n(H2) | P(Mpa) |
| i | 150 | 1/3 | 0.1 |
| ii | | | 5 |
| iii | 350 | | 5 |
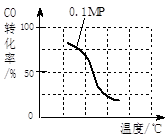
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com