
| A. | 二氧化硅和冰的熔化 | B. | 氯化钠和铁的熔化 | ||
| C. | 烧碱和金刚石的熔化 | D. | 碘和干冰的升华 |
科目:高中化学 来源: 题型:选择题
| A. | “物质的量”是衡量物质重量的物理量 | |
| B. | 氢氧化钠的摩尔质量是40g | |
| C. | 物质的量浓度的常用单位是mol•L-1 | |
| D. | 1mol任何物质所占有的体积都是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H2CO3)+c(H+) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③②①④ | B. | ①④②③ | C. | ④①②③ | D. | ②③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提取食盐后的母液$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{稀HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| B. | Cu$\stackrel{H_{2}O_{2},稀H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{蒸发,结晶}{→}$CuSO4•5H2O | |
| C. | 饱和食盐水$\stackrel{NH_{3}}{→}$$\stackrel{CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | N2$→_{催化剂}^{H_{2}}$NH3$→_{催化剂}^{O_{2}}$NO→NO2$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4可用于鉴别溴水和碘水 | |
| B. | 用AgNO3溶液可以鉴别KCl和KI | |
| C. | 氯水久置后酸性减弱 | |
| D. | 在饱和氯水中通入H2S气体,溶液的酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O | B. | 2NaCl(熔融) $\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | D. | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
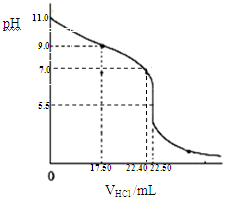 测定室温下NH3•H2O的浓度及电离平衡常数Kb
测定室温下NH3•H2O的浓度及电离平衡常数Kb查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com