
(15分)钌(Ru)的硫化物可用元素合成法(下称干法)和湿法获得。干法用99.9%的纯钌粉和99.99%的硫按化学计量配料,充分混合,置于石英管中,抽真空并加热至800℃反应生成,经X-射线检定为晶态。湿法:可在六氟合钉(Ⅳ)酸溶液中,加硫代乙酰胺CH3-![]() -NH2水解沉淀生成,X射线检定为非晶态。制得的两种硫化物,在较高温度下用氢气还原,生成的H2S利用库仑滴定法进行测定,可计算出硫量,还原后得到的金属钌进行称量测定。两种方法制得的硫化物在空气中都有微吸湿性,利用失重法可计算出化合物的含水量。其实验数据如下:
-NH2水解沉淀生成,X射线检定为非晶态。制得的两种硫化物,在较高温度下用氢气还原,生成的H2S利用库仑滴定法进行测定,可计算出硫量,还原后得到的金属钌进行称量测定。两种方法制得的硫化物在空气中都有微吸湿性,利用失重法可计算出化合物的含水量。其实验数据如下:
试样组成 | S | Ru | H2O |
(1)干法 | 37.26% | 60.06% | 2.73% |
(2)湿法 | 20.63% | 41.84% | 37.36% |
1.试推断干法和湿法制得的两种硫化物的化学式。
2.写出湿法制备硫化物的反应方程式(要求配平)。
3.哪种方法制得的硫化物测定结果偏高?导致结果偏高的原因可能是什么?
4.用氢还原钌的硫化物,每升温20℃,保温5分钟,同时库仑滴定这一期间释放的H2S量,直到无H2S逸出,化合物还原为金属钌为止。若以滴定S2-离子的时间(s)为纵坐标,温度(℃)为横坐标作图,得钌硫化物被氢还原的反应速率相对于温度的动力学曲线,如下图:
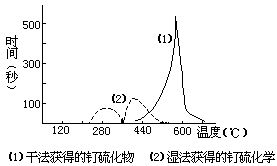
据此,比较两种硫化物对氢作用的稳定性
5.图中湿法制得的硫化物有两个脱硫峰,而且由第一个峰测得的硫含量大约为化合物含硫总量的1/3。据此,推测氢还原湿法制得的钌硫化物的过程。
6.图中(2)的第二个脱硫峰的温度区间比(1)脱硫峰要低,其可能原因是什么?
1.干法:
![]() =0.59411.1620.151=11.960.26
=0.59411.1620.151=11.960.26
考虑硫化物的微量吸湿性,所以化学式为RuS2(2分)
湿法:
![]() =0.41380.64352.076=23.1110.03
=0.41380.64352.076=23.1110.03
考虑到硫化物的微量吸湿性,所以化学式为Ru2S3?10H2O(2分)
2.2H2[RuCl6]+4CH3-![]() -NH2+18H2O=Ru2S3?10H2O↓+4CH3COOH+4NH4Cl+S↓+8HCl(2分)
-NH2+18H2O=Ru2S3?10H2O↓+4CH3COOH+4NH4Cl+S↓+8HCl(2分)
3.湿法制得的硫化物含硫结果偏高,这是由于它吸附硫,未完全洗净的缘故(2分)
4.干法制得的硫化物对氢作用更稳定(2分)
5.有两个脱硫峰说明有两种硫化物,即为RuS?RuS2,所以氢还原过程:第一步,约200℃以前脱去结晶水;第二步,200~360℃ RuS+H2→Ru+H2S;第三步,360~550℃,RuS2+2H2→Ru+2H2S(3分)
6.湿法制得的硫化物的第一个脱硫峰产生的新生态钌,可能对第二个脱硫峰的脱硫过程具催化作用(2分)


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com