
| A.天然气 | B.太阳能 | C.石油 | D.煤 |
科目:高中化学 来源:不详 题型:单选题
| A.钢铁发生析氢腐蚀时,负极电极反应是Fe-2e-=Fe2+ |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| C.将pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸所需加入的水多 |
| D.一定温度下,反应MgCl2(l)=Mg(l)+ Cl2(g)的△H>0△S>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.用酸式滴定管取稀H2SO425.00mL,注入锥形瓶中,加入指示剂。 |
| B.用待测定的溶液润洗酸式滴定管 |
| C.用蒸馏水洗干净滴定管 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下 |
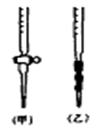
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
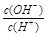 =1×10-6,下列叙述正确的是
=1×10-6,下列叙述正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
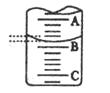
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.32 | 25.28 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | ① | ② | ③ | ④ |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2CO(g)+O2 (g)=2CO2(g)△H = ―556kJ·mol-1 |
| B.CH4(g)+2O2(g)=CO2 (g)+2H2O (l)△H = ―890kJ·mol-1 |
| C.2H2 (g)+O2(g)=2H2O(l)△H = ―571.6kJ·mol-1[ |
| D.H2 (g)+Cl2(g)=2HCl(g)△H = ―184.6kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.13 | B.14 | C.15 | D.不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com