
| A. | Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 | |
| B. | 第2周期元素从Li到F,得电子能力逐渐增强 | |
| C. | 元素原子的最外层电子数等于元素的最高正化合价 | |
| D. | O与S为同主族元素,且O比S的得电子能力强 |
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
| V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
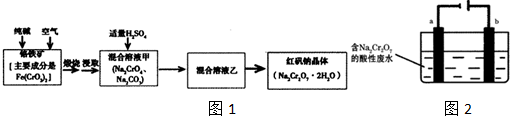
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | 在一定条件下,CO2原子晶体转化为分子晶体是物理变化 | |
| C. | CO2的原子晶体和CO2分子晶体具有相同的物理性质 | |
| D. | 在CO2的原子晶体中,每个碳原子周围结合四个氧原子,每个氧原子周围结合两个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com