
 |  |  |  |
| A.将NaOH溶液存 放在玻璃瓶中 | B.检验试液中NH4+ 的存在 | C.干燥CO2气体 | D.收集HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 原混合物中Cu为12.8g | B. | 原溶液中c(SO42-)=0.15mol•L-1 | ||
| C. | 反应后溶液中Cu2+为0.3mol | D. | 反应后溶液中c(SO42-)为0.8mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
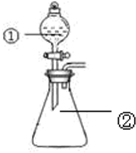 用如图所示装置进行下列实验:将①中溶液滴入②锥形瓶中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②锥形瓶中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D. | SO2饱和溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 离子的还原性:S2->Cl->Br->I- | |
| C. | 酸性:H2SO4>H3PO4>H2CO3>HClO | |
| D. | 金属性:Be<Mg<Ca<K |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能自发进行 | |
| C. | 反应物和生成物所具有的总焓决定了反应是放热还是吸热 | |
| D. | 放热反应在任何条件下也能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水中通入过量二氧化碳:OH-+CO2═HCO3- | |
| B. | 向水玻璃中中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | Fe3O4与稀硝酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 L Cl2含有的分子数为0.5NA | |
| B. | 在常温常压下,17 g NH3所含的原子数为4NA | |
| C. | 标准状况下,11.2 L CCl4所含的分子数为0.5NA | |
| D. | 56g金属铁与足量的氯气反应时,失去的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com