
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ·mol—1) | 414.4 | 615.3 | 347.4 | 435.3 |
科目:高中化学 来源:不详 题型:填空题
 量。
量。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.B2H6(g)+3O2(g)====B2O3(s)+3H2O(l);ΔH="+2" 165 kJ·mol-1 |
| B.B2H6(g)+3O2(g)====B2O3(s)+3H2O(l);ΔH="-2" 165 kJ·mol-1 |
| C.B2H6+3O2====B2O3+3H2O;ΔH="-2" 165 kJ·mol-1 |
| D.B2H6(g)+O2(g)====B2O3(s)+H2O(g);ΔH="-2" 165 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
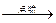 12CO2(g)+4CO(g)+18H2O(l)
12CO2(g)+4CO(g)+18H2O(l)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
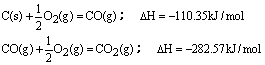
| A.39.292kJ | B.3274.3kJ | C.784.92kJ | D.2489.44kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 催化剂 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.室温下不能自发进行的反应,在高温下有可能自发进行 |
| B.熵增加有利于反应的自发进行,熵减少的反应常温下都不会自发进行 |
| C.非自发反应在任何情况下都不会发生 |
| D.△H-T△S作为化学反应方向的判据,在任何条件下都适用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2H4+O2=N2+2H2O△H = —534.4kJ/mol |
| B.N2H4(g)+ O2(g)=N2(g)+2H2O(g)△H = —16.7kJ/mol |
| C.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H = —534.4kJ/mol |
| D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H = —534.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
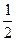 O2(g)=H2O(1) △H=-285.8kJ·mol-1
O2(g)=H2O(1) △H=-285.8kJ·mol-1| A.1:1 | B.1:3 | C.1:4 | D.2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com