
���� 2minĩ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��������1mol D��v��D��=$\frac{\frac{1mol}{2L}}{2min}$=0.25mol/��L��min���������C��Ũ��Ϊ0.5mol•L-1��v��C��=$\frac{0.5mol/L}{2min}$=0.25mol/��L��min����������֮�ȵ��ڻ�ѧ������֮�ȿ�֪x=2����
3A��g��+B��g��?2C��g��+2D��g��
��ʼ 1.5 0.5 0 0
ת�� 0.75 0.25 0.5 0.5
ƽ�� 0.75 0.25 0.5 0.5
K=$\frac{0��{5}^{2}��0��{5}^{2}}{0.7{5}^{3}��0.25}$=$\frac{16}{27}$��
�����Qc��K�ж�ƽ���ƶ�������ϸ÷�ӦΪ���ȷ�Ӧ����Чƽ�������
��� �⣺��1��2minĩ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��������1mol D��v��D��=$\frac{\frac{1mol}{2L}}{2min}$=0.25mol/��L��min���������C��Ũ��Ϊ0.5mol•L-1��v��C��=$\frac{0.5mol/L}{2min}$=0.25mol/��L��min����������֮�ȵ��ڻ�ѧ������֮�ȿ�֪x=2��
�ʴ�Ϊ��2��
��2��3A��g��+B��g��?2C��g��+2D��g��
��ʼ 1.5 0.5 0 0
ת�� 0.75 0.25 0.5 0.5
ƽ�� 0.75 0.25 0.5 0.5
K=$\frac{0��{5}^{2}��0��{5}^{2}}{0.7{5}^{3}��0.25}$=$\frac{16}{27}$��
�÷�ӦΪ���ȷ�Ӧ�������¶�ʱƽ�������ƶ���Kֵ����С��
�ʴ�Ϊ��$\frac{16}{27}$����С��
��3����ά���¶Ȳ��䣬��ԭƽ��������������ٳ���A��B��C��D��1mol��Ũ�ȷֱ�Ϊ1.25mol/L��0.75mol/L��1mol/L��1mol/L����Qc=$\frac{{1}^{2}��{1}^{2}}{1.2{5}^{3}��0.75}$=0.68��K����ƽ�������ƶ�������ʱv��С��v����
�ʴ�Ϊ��С�ڣ�
��4����ά���¶Ⱥ�������䣬��ԭƽ��������������ٳ���3mol A��1mol B��ƽ�ⲻ�ƶ�����ԭƽ���Ч����A�����������ͬ����Ϊ$\frac{0.75mol/L}{0.75mol/L+0.25mol/L+0.5mol/L+0.5mol/L}$��100%=37.5%��
�ʴ�Ϊ��37.5%��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬���ջ�ѧƽ�����η���K��Qc�ļ��㼰Ӧ��Ϊ���Ĺؼ������ط�������������Ŀ��飬ע�⣨4���е�Чƽ���Ӧ�ã���Ŀ�ѶȲ���


 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д� ���������ν�ϵ�д�
���������ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ϡ�����ܲ�����ɫ���壬��һ����CO32- | |
| B�� | �����Ȼ�����Һ�а�ɫ�����������ټ����ᣬ��������ʧ����һ����Ag+ | |
| C�� | ��������������Һ�����ȣ�������������ʹʪ���ɫʯ����ֽ��������һ����NH4+ | |
| D�� | ����̼������Һ������ɫ�������ټ����ᣬ��ɫ������ʧ����һ����Ca2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | t1ʱ�ı�ijһ��������ͼ��ʾ�仯����ı������һ���Ǽ������ | |
| B�� | ��Ӧ�ﵽƽ��ʱ�����������ƽ��Ӱ���ϵ��ͼ��ʾ����b=1��aΪ����������P1��P2 | |
| C�� | �Ӽ��뷴Ӧ�↑ʼ�����ʵİٷֺ������¶ȹ�ϵ��ͼ��ʾ����÷�Ӧ������ӦΪ���ȷ�Ӧ | |
| D�� | ��Ӧ���ʺͷ�Ӧ�����仯��ͼ��ʾ����÷�Ӧ����ӦΪ���ȷ�Ӧ��A��Bһ�������壬Dһ���������壬C���ܲ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
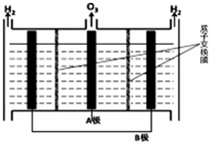 NO������⻯ѧ�������ƻ������㣮����NO�ж��ַ��������������ش��������⣺
NO������⻯ѧ�������ƻ������㣮����NO�ж��ַ��������������ش��������⣺| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | �� |
| c��NO��/mol•L-1 | 1.00��10-3 | 4.00��10-4 | 1.70��10-4 | 1.00��10-4 | 1.00��10-4 | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����


 ���ķ�ˮ����ͨ�����������س�ȥ����ԭ����ͼ5��ʾ��
���ķ�ˮ����ͨ�����������س�ȥ����ԭ����ͼ5��ʾ��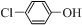 +2e-+H+�T
+2e-+H+�T -OH+Cl-��
-OH+Cl-���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�2.24 Lˮ�к��еķ�����ԼΪ0��l NA | |
| B�� | �ڳ��³�ѹ�£�1 mol He���е�ԭ����ΪNA | |
| C�� | 2.4g����þ��Ϊþ����ʱʧȥ�ĵ�����Ϊ0.1NA | |
| D�� | ���ʵ���Ũ��Ϊ0.5mol/L FeCl3��Һ��Cl-����ĿΪ1.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 molN2��3 mol H2��Ӧ���ɵ�NH3������Ϊ2NA | |
| B�� | 2.4gþ��������������ȼ�գ�ת�Ƶĵ�����Ϊ0.1NA | |
| C�� | ��״���£�2.24L��CCl4�к��е�C-Cl����Ϊ0.4NA | |
| D�� | ��״���£�5.6L������̼�����к��е���ԭ����Ϊ0.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һ�У�NH4+��Cu2+��SO42-��Cl- | |
| B�� | ���д���Fe2+����Һ�У�K+��Mg2+��C1O-��SO42- | |
| C�� | �������þ�ܲ���H2����Һ�У�Na+��Fe2+��SO42-��NO3- | |
| D�� | ˮ���������c��OH-��=l��10-12mol/L����Һ�У�Al3+��SO42-��NO3-��Cl- |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com