
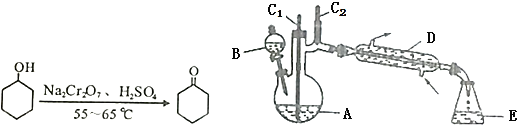
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:
有关物质的物理性质见表。
物质 | 沸点(℃) | 密度(g/cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)仪器D的名称为_____。
(2)①滴加酸性Na2Cr2O7溶液时反应的离子方程式为______________;(![]() 被还原为Cr3+)
被还原为Cr3+)
②蒸馏不能分离环己酮和水的原因是_____。
(3)环己酮需要经过以下操作提纯:
a.往液体中加入NaCl固体至饱和,静置,分液
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.加入无水MgSO4固体,除去有机物中少量的水
d.过滤
e.蒸馏、除去乙醚后,收集151~156℃馏分
①b中水层用乙醚萃取的目的是_____;
②上述操作a、d中使用的玻璃仪器除烧杯、玻璃棒外,还需要的玻璃仪器有____、___,操作a中,加入NaCl固体的作用是_____。
(4)恢复至室温时,分离得到纯产品体积为8mL,则环己酮的产率为____。(保留3位有效数字)
【答案】(直形)冷凝管 3![]() +
+![]() +8H+=3
+8H+=3![]() +2Cr3++7H2O 环己酮和水形成具有固定组成的混合物将一起蒸出 使水层中少量的有机物进一步被提取,提高产品的产量 漏斗 分液漏斗 降低环己酮的溶解度,增加水层的密度,有利于分层 80.8%
+2Cr3++7H2O 环己酮和水形成具有固定组成的混合物将一起蒸出 使水层中少量的有机物进一步被提取,提高产品的产量 漏斗 分液漏斗 降低环己酮的溶解度,增加水层的密度,有利于分层 80.8%
【解析】
本实验的目的是制备环己酮,装置A中利用酸性Na2Cr2O7溶液将环己醇在55~65℃时氧化得到环己酮,反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物;之后进行提纯,首先往液体中加入NaCl固体至饱和,从而降低环己酮的溶解度,并且增加水层的密度,静置后分液;分液后水层用乙醚萃取,进一步提取水层中环己酮并入有机层;之后用无水硫酸镁除去有机物中少量的水分,过滤后蒸馏分离乙醚,得到纯净的环己酮。
(1)装置D的名称是冷凝管,具有冷凝蒸汽作用;
(2)①酸性条件下,Cr2O![]() 氧化环己醇生成环己酮,Cr2O
氧化环己醇生成环己酮,Cr2O![]() 被还原生成Cr3+,根据得失电子守恒、元素守恒和电荷守恒可得反应的离子方程式为3
被还原生成Cr3+,根据得失电子守恒、元素守恒和电荷守恒可得反应的离子方程式为3![]() + Cr2O
+ Cr2O![]() +8H+=3
+8H+=3![]() +2Cr3++7H2O;
+2Cr3++7H2O;
②环己酮和水能形成具有固定组成的混合物,具有固定的沸点,蒸馏时能被一起蒸出,所以蒸馏难以分离环己酮和水的混合物;
(3)①环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚微溶于水,可用乙醚作萃取剂,将水中的剩余的环己酮进一步萃取到乙醚中,从而提高产品产量;
②分液需要的玻璃仪器为分液漏斗、烧杯,过滤需要的玻璃仪器为烧杯、漏斗、玻璃棒;操作a中,加入NaCl固体的作用是:NaCl能增加水层的密度,降低环己酮的溶解,且有利于分层;
(4)环己醇的质量为10mL×0.96g/mL=9.6g,理论上得到环己酮质量=![]() ×98g/mol=9.408g,实际上环己酮质量为8mL×0.95g/mL=7.6g,则环己酮产率=
×98g/mol=9.408g,实际上环己酮质量为8mL×0.95g/mL=7.6g,则环己酮产率=![]() ×100%=80.8%。
×100%=80.8%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________;
(2)X与金属钠反应放出氢气,反应的化学方程式是____________(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是________________;
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍氢电池是二十世纪九十年代发展起来的一种新型绿色电池,具有高能量、长寿命、无污染等特点。用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图1所示。电池的总反应式为:2Ni(OH)2 ![]() H2+2NiO(OH)
H2+2NiO(OH)

(1)①镍氢电池充电时,碳电极连接直流电源的______极。阳极的电极反应式为______
②镍氢电池放电时,OH-移向______(填“碳电极”或“镍电极”)。
(2)除了用纳米碳管等材料储氢外,还可使用有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢。一定条件下,利用图2装置可实现有机物的电化学储氢(忽略其它有机物)。
①A为电源的______极。
②电极E上产生的气体为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PH=1的醋酸加水稀释到原体积的100倍,稀释后PH=3
B. 室温 pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性
C. 室温pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同
D. 某温度下,水的离子积常数为1×10-12,该温度下PH=7的溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下不能实现的是( )
A.NH3![]() NO
NO![]() HNO3
HNO3
B.浓盐酸![]() Cl2
Cl2![]() 漂白粉
漂白粉
C.Al2O3![]() AlCl3(aq)
AlCl3(aq) ![]() 无水AlCl3
无水AlCl3
D.葡萄糖![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,将 2 mol A 和 3 mol B 充入一密闭容器中,发生反应:aA(g)+B(g) ![]() C(g)+D(g),5 min 后达平衡,已知各物质的平衡浓度的关系为 ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的 10 倍,A 的转化率没有发生变化, 则B 的转化率为( )
C(g)+D(g),5 min 后达平衡,已知各物质的平衡浓度的关系为 ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的 10 倍,A 的转化率没有发生变化, 则B 的转化率为( )
A.60%B.40%C.24%D.4%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________。
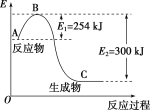
(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及(1)的图中数据计算N—H键的键能为________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=________kJ·mol-1(用含a、b的式子表示)。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com