
已知工业上真空炼铷的原理如下:2RbCl+Mg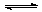 MgCl2+2Rb(g),对于此反应的进行能给予正确解释的是 ( )
MgCl2+2Rb(g),对于此反应的进行能给予正确解释的是 ( )
A.铷的金属活动性不如镁强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.MgCl2的热稳定性不如Rb强
D.铷的单质状态较化合态更稳定
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
两种化合物A和B只含C、H、O三种元素。若A和B以任意物质的量比混合,完全燃烧后生成CO2的体积都是消耗O2体积的2倍(同温同压下测定),即它们的分子组成符合通式:
(CO)x(H2O)y(x、y为正整数)。已知A和B的相对分子质量分别是a和b,且a>b。
请按要求回答下列问题:
(1)若A、B分子中氢原子数相同,A、B相对分子质量的差值一定是(填一个数字)
的整数倍。
(2)试写出符合此条件且A和B的相对分子质量最小的化合物的分子式:A ,B ;结构简式:A ,B 。
(3)写出与(2)中B相对分子质量相差14,且不属于同类物质的两种分子的结构简式: 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在给定一定物质的量的理想气体,影响其所占体积大小的主要因素是 ( )
A.分子直径的大小 B.分子间距离的大小
C.分子间引力的大小 D.分子数目的多少
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各电离方程式中,书写正确的是 ( )
A.CH3COOH 
 H++CH3COO-
H++CH3COO-
B.KHSO4 
 K++H++SO
K++H++SO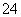
C.Al(OH)3===Al3++3OH-
D.NaH2PO4 
 Na++H2PO
Na++H2PO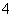
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH—O键形成时放出热量463kJ,则氢气中1molH—H键断裂时吸收热量为 ( )
A.872kJ B.557kJ C.436kJ D.188kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为____________;经测定溶液中含CH3COO-为1.4×10-3 mol/L,此温度下醋酸的电离常数:Ka=________,温度升高电离平衡向 移动,Ka将________(填“变大”“不变”或“变小”下同);加水稀释CH3COOH的电离程度 ,Ka将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏伽德罗常数,下列叙述错误的是
A.常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA
B.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子
C.由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA
D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铜是一种应用极其广泛的化工原料。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。


(1)图1烧瓶中发生的离子反应方程式为:
(2)图2是图1的改进装置,其优点有:
① ;② 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤.蒸发.结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7.6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。a.CaO b.CuCO3 c.CaCO3 d.NH3▪H2O
以加入FeSO4为例,用离子方程式解释反应发生的原因
。
方案3 :将3.2g铜丝放到45 mL 1.5mol/L的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5小时后,升温到60℃,持续反应1 小时后,过滤.蒸发结晶.减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O10.6g。
③上述三种方案中,更符合绿色化学理念的是 ,(填方案1、方案2、方案3)
理由是 . . 。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,四种溶液的pH如下表:

下列说法正确的是
A. 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B. 将V1 mL④溶液与V2mL②溶液混合后,测得混合溶液pH=4,则V1:V2=9:11
C. 分别加水稀释10倍,四种溶液的pH大小顺序为①〉②〉③〉④
D. 将①、④两种溶液等体积混合,所得溶液中•
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com