
| A. | v(A)=0.030 mol/(L•s) | B. | v(B)=0.075 mol/(L•s) | ||
| C. | v(C)=0.030 mol/(L•s) | D. | v(D)=0.030 mol/(L•s) |
分析 在0.5L密闭容器中进行,30s后A减少了0.90mol,则v(A)=$\frac{\frac{0.9mol}{0.5L}}{30s}$=0.060 mol/(L•s),然后结合速率之比等于化学计量数之比计算.
解答 解:在0.5L密闭容器中进行,30s后A减少了0.90mol,则v(A)=$\frac{\frac{0.9mol}{0.5L}}{30s}$=0.060 mol/(L•s),
由速率之比等于化学计量数之比可知,v(B)=0.060 mol/(L•s)×$\frac{5}{4}$=0.075 mol/(L•s),
v(C)=0.060 mol/(L•s),v(D)=0.060 mol/(L•s)
故选B.
点评 本题考查化学反应速率与化学计量数的关系,为高频考点,把握速率的计算及与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
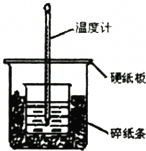 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
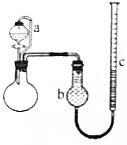 某研究性学习小组为了测定镀锌薄铁板(假设只含Fe和Zn)中锌的质量分数ω(Zn),用如图所示装置(夹持装置略去)进行实验,通过测定产生H2的体积计算ω(Zn).已知:①锌易溶于强碱溶液,发生反应为Zn+2NaOH═Na2ZnO2+H2↑.②所用的镀锌薄铁板均为m1g.回答下列问题:
某研究性学习小组为了测定镀锌薄铁板(假设只含Fe和Zn)中锌的质量分数ω(Zn),用如图所示装置(夹持装置略去)进行实验,通过测定产生H2的体积计算ω(Zn).已知:①锌易溶于强碱溶液,发生反应为Zn+2NaOH═Na2ZnO2+H2↑.②所用的镀锌薄铁板均为m1g.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 18种 | C. | 21种 | D. | 36种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | .①②③ | C. | .②③④ | D. | .①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11H、21H、31H、H+和H2是氢元素的五种不同粒子 | |
| B. | 白磷和红磷的相互转化属于物理变化 | |
| C. | 11H和21H是不同的核素 | |
| D. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com