
| A. | 氢化物稳定性:HBr>HCl>PH3 | B. | 离子半径:Na+>Cl->F- | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 离子的还原性 Cl>Br>I |
分析 A、元素的非金属性越强,气态氢化物稳定性越强;
B、电子层越多,半径越大,电子层一样,核电荷数越多,半径越小;
C、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
D、元素的非金属性越强,其阴离子的还原性越弱.
解答 解:A、元素的非金属性越强,气态氢化物稳定性越强,元素的非金属性Cl>Br,气态氢化物稳定性HCl>HBr,故A错误;
B、电子层越多,半径越大,电子层一样,核电荷数越多,半径越小,所以离子半径由大到小:F->Na+,故B错误;
C、元素的金属性:Na>Mg>Al,所以碱性:NaOH>Mg(OH)2>Al(OH)3,故C正确;
C、由于非金属性Cl>Br>I,故阴离子的还原性:Cl-<Br-<l-,故D错误;
故选C.
点评 本题考查较为综合,涉及元素非金属性、非金属性,微粒半径大小、氢化物稳定性等知识,侧重于学生的分析能力的考查,注意把握元素周期律的递变规律,难度中等,学习中注意积累.


科目:高中化学 来源: 题型:解答题
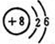
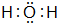 、
、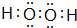 ,属于共价化合物.
,属于共价化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1471kJ/mol | B. | -1471kJ/mol | C. | 93kJ/mol | D. | -93kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适量浓H2SO4 | B. | 硫酸钾固体 | C. | 醋酸钠固体 | D. | 硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
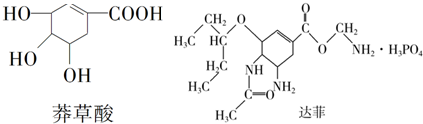
| A. | 莽草酸可溶于水 | |
| B. | 1 mol莽草酸最多可和4 molNaOH溶液反应 | |
| C. | 从结构上推测,达菲既可与盐酸反应又可与氢氧化钠溶液反应 | |
| D. | 从结构上推测,以莽草酸为原料合成达菲须经过酯化反应等步骤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com