
【题目】![]() 某烃与一定量的氧气恰好完全反应生成
某烃与一定量的氧气恰好完全反应生成![]() 及
及![]()
![]() ,若该烃与
,若该烃与![]() 只能按物质的量之比为
只能按物质的量之比为![]() 发生加成反应,则下列关于该烃的叙述错误的是( )
发生加成反应,则下列关于该烃的叙述错误的是( )
A.该烃的分子式为![]() B.该物质可能是炔烃或二烯烃
B.该物质可能是炔烃或二烯烃
C.该烃的键线式可能是![]() 或
或![]() D.该烃的官能团是碳碳双键
D.该烃的官能团是碳碳双键
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
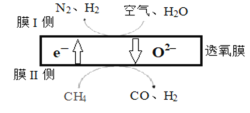
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图所示(空气中N2和O2的物质的量之比为4:1)。上述过程中,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,则氧化作用的物质为_______________,膜Ⅱ侧发生的电极反应式为_________________
(2)用CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g) CH3OH(g) △H1
已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.1kJ/mol
则△H1=________________
(3)向体积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应:CO(g)+2H2(g) CH3OH(g),平衡时,CO的转化率α(CO)随温度、压强的变化情况如图1所示。
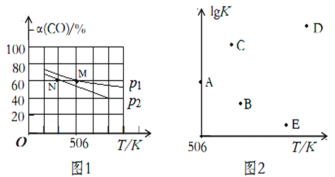
①压强p1_____(填“>”、“<”或“=”)p2;M点时,该反应的平衡常数Kp=______(用平衡分压表示,分压=总压×物质的量分数)
②不同温度下,该反应的平衡常数的对数值lgK如图2,其中A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是_____________
(4)H2还原NO的反应为2NO(g)+2H2(g)N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(H2)/(mol·L-1) | c(NO)/(mol·L-1) | v/(mol·L-1·min-1) |
1 | 0.10 | 0.10 | 0.414 |
2 | 0.10 | 0.20 | 1.656 |
3 | 0.50 | 0.10 | 2.070 |
由表中数据可知,m=_______,n=_______。
②上述反应分两步进行:ⅰ2NO(g)+2H2(g) N2(g)+H2O2(l)(慢反应)
ⅱH2O2(l)+H2(g) 2H2O(l)(快反应)。下列说法正确的是_______
A. H2O2是该反应的催化剂 B. 总反应速率由反应ⅱ的速率决定
C. 反应ⅰ的活化能较高 D.反应ⅰ中NO和H2的碰撞仅部分有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)微溶于水,不溶于乙醇,在空气中会被迅速氧化,其制备有很多方法,工业上可以废旧铜为原料生产氯化亚铜。
方法一:
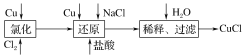
(1)CuCl可以溶解在FeCl3溶液中,请写出该反应的离子方程式是:____。
(2)还原过程中的产物为Na[CuCl2],试写出发生反应的化学方程式是__________,过滤操作用到的玻璃仪器有_______________________________。
(3)制备结束后所得产品用酒精淋洗的目的是_________________。
方法二:
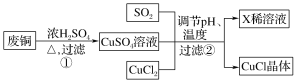
(4)a.写出过程①的主要反应的化学方程式_____________________。
b.为了更好体现绿色化学思想,有人提出如下方案:
方案一:可将上述X稀溶液用于废铜的处理(如图所示),则Y可以为________(填化学式)。
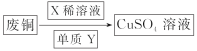
方案二:过程①中Cu与浓H2SO4反应所得SO2和CuSO4用于过程②中CuCl的制备,理论上________(填“需要”或“不需要”)另外补充SO2,原因是_______________________(结合化学方程式回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钛镁合金是制造高性能飞机的重要材料。金属钛、镁均采用六方最密堆积,下列说法正确的是_____(填序号)。
A.钛镁合金用于制造高性能飞机主要是由于它们的价格昂贵,制造出的飞机能卖好价钱
B.钛、镁金属晶体中,其配位数均为12
C.金属钛的熔点(1668℃)很高,与金属键无关
(2)钙钛型复合氧化物可用于制造航母中的热敏传感器,其晶胞结构如图所示,其中A为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有很好的电学性能。下列说法正确的是______(填序号)。
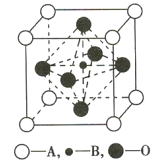
A.金属Ca、Sr、Ba采用体心立方密堆积
B.用A、B、O表示的钙钛型复合氧化物晶体的化学式可表示为ABO3
C.在制造Fe薄片时,金属键完全断裂
D.V、Cr、Mn、Fe晶体中均存在金属阳离子和阴离子
(3)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有![]() 三种同素异形体,其晶胞结构如图所示。
三种同素异形体,其晶胞结构如图所示。
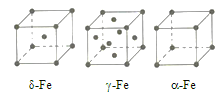
①![]() 晶胞中含有的铁原子数为___________。
晶胞中含有的铁原子数为___________。
②![]() 、
、![]() 两种晶体中铁原子的配位数之比为___________。
两种晶体中铁原子的配位数之比为___________。
③若![]() 晶胞的边长为a cm,
晶胞的边长为a cm, ![]() 晶胞的边长为b cm,则两种晶体的密度之比为___________。
晶胞的边长为b cm,则两种晶体的密度之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种新型热激活电池的结构如图所示,电极a的材料是氧化石墨烯(CP)和铂纳米粒子,电极b的材料是聚苯胺(PANI),电解质溶液中含有Fe3+和Fe2+。加热使电池工作时电极b发生的反应是PANI-2e-=PANIO(氧化态聚苯胺,绝缘体)+2H+,电池冷却时Fe2+在电极b表面与PANIO反应可使电池再生。下列说法不正确的是
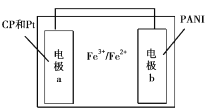
A.电池工作时电极a为正极,且发生的反应是:Fe3++e-—Fe2+
B.电池工作时,若在电极b周围滴加几滴紫色石蕊试液,电极b周围慢慢变红
C.电池冷却时,若该装置正负极间接有电流表或检流计,指针会发生偏转
D.电池冷却过程中发生的反应是:2Fe2++PANIO+2H+=2Fe3++ PANI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() 与
与![]() 可以通过配位键形成
可以通过配位键形成![]() 。
。
(1)在![]() 中,___________________原子提供孤电子对,___________________原子接受孤电子对。
中,___________________原子提供孤电子对,___________________原子接受孤电子对。
(2)写出![]() 的结构式,并用“→”标出配位键:____________________。
的结构式,并用“→”标出配位键:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H12的苯的同系物,已知苯环上只有一个取代基,下列说法中正确的是 ( )
A. 该有机物能发生加成反应,但不能发生取代反应
B. 该有机物不能使酸性高锰酸钾溶液和溴水褪色
C. 该有机物分子中的所有原子不可能在同一平面上
D. 该有机物的一溴代物最多有5种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奶粉中蛋白质含量的国家标准是:每100g婴幼儿奶粉中含蛋白质![]() 。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨,由氨计算出氮,再由氮求出蛋白质的含量(蛋白质的含氮量按16%计算)。某市质检局对市场中某个品牌的婴幼儿奶粉进行检验,取
。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨,由氨计算出氮,再由氮求出蛋白质的含量(蛋白质的含氮量按16%计算)。某市质检局对市场中某个品牌的婴幼儿奶粉进行检验,取![]() 该奶粉样品进行反应后,生成的
该奶粉样品进行反应后,生成的![]() 和
和![]() 质量分数为19.6%的稀硫酸能恰好完全反应生成正盐,该品牌的婴幼儿奶粉属于________(填“合格”或“不合格”)奶粉。
质量分数为19.6%的稀硫酸能恰好完全反应生成正盐,该品牌的婴幼儿奶粉属于________(填“合格”或“不合格”)奶粉。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com