
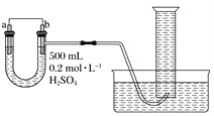
����Ŀ��������ͼװ�����ⶨijԭ��ع���ʱ��ij��ʱ����ͨ�����ߵĵ��ӵ����ʵ�������Ͳ�Ĺ��Ϊ1 000 mL����ѡ��ĵ缫�����д�ͭƬ�ʹ�пƬ��
��ش��������⣺
��1��b�缫����Ϊ___����缫��ӦʽΪ____��
��2������Ͳ���ռ���672 mL(��״����)����ʱ��ͨ�����ߵĵ��ӵ����ʵ���Ϊ___mol����ʱa�缫����____(��������������������)___g��
��3�������a��b���缫�ĵ缫���϶Ե���U�ι��н����ֵ�������____��
���𰸡�ͭ 2H����2e��===H2�� 0.06 ���� 1.95 ���Һ���½����Ҷ�Һ������
��������
(1)��ͭƬ�ʹ�пƬ��ϡ�������ԭ���,��ͼ��֪b�缫������������,��bΪͭ,Ϊ����;aΪп,Ϊ����;b�������ӵõ�����������,��缫��ӦʽΪ��2H++2e�TH2����
�ʴ�Ϊ��ͭ;2H++2e�TH2����
(2)����Ͳ���ռ���672mL(��״����)����,��n(H2)=V/Vm=0.672L/22.4L/mol=0.03mol��,��֪b�ϵĵ缫��ӦʽΪ��2H++2e�TH2��,��ͨ�����ߵĵ��ӵ����ʵ���Ϊ0.06mol,a�缫�ϵķ�ӦΪ��Zn2e�TZn2+�����ܽ��Zn�����ʵ���Ϊ0.03mol�����С��Zn������Ϊ65g/mol��0.03mol=1.95g��
�ʴ�Ϊ��0.06����С��1.95��
(3)�����a��b���缫�ĵ缫���϶Ե������ұ�Ϊпʧ���������������ΪͭΪ�����������ӵõ�����������������������������ɣ�����U�ι������Һ���½����Ҷ�Һ��������
�ʴ�Ϊ�����Һ���½����Ҷ�Һ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ���������ȷ���ǣ���
A.������ˮ��Al3++3H2O![]() Al(OH)3��+3H+
Al(OH)3��+3H+
B.�Ȼ������ˮ��NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
C.��������Һ�У�H2SO3![]() 2H++SO32-
2H++SO32-
D.��С�մ���Һ�еμ��������ƣ�HCO3��+OH��=CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ�����ȡ���ϡ��㾫��Ⱦ�ϡ�Ϳ�ϡ�ϴ�Ӽ��Ȳ�Ʒ��ԭ�ϡ�
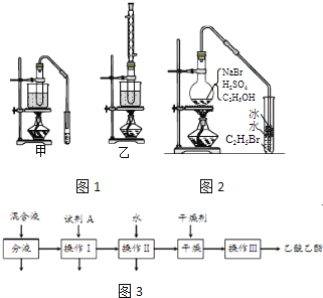
���������գ�
��1��ʵ�������Ҵ���ȡ��ϩʱ��Ũ���������ԶԶ������Ϊ����������������ԭ����______��
��2����֤��ϩ�ӳɷ�Ӧ����ʱ�������ϩ�����еĸ������ʽ��д�������ѡ�õ��Լ���_____����д��ѧʽ������ȷ����ϩͨ����ˮ�з����˼ӳɷ�Ӧ����ʵ��______����ѡ���ţ�
a����ˮ��ɫ b������״��������
c����Ӧ��ˮ��Һ������ǿ d����Ӧ��ˮ��Һ�ӽ�����
��3��ʵ�������Ҵ��������Ʊ���������ʱ���ס�������װ����ͼ1������ѡ�á�����������װ�õ�˵����ȷ����______����ѡ���ţ�

a����װ������ת���ʸ� b����װ������ת���ʸ�
c����װ��������������ʩ d����װ��������������ʩ
��4������װ��ʵ��ʱ���ᴿ��������������������ͼ3�����������Լ�A�Ļ�ѧʽ��______���������������______��������һ�������ڷ���______����
��5����ͼ2�����Ҵ��Ʊ��������װ�ã�ʵ���������ּ��Ϸ�����
���ȼ��廯�����ټ��Ҵ�������1��1Ũ���
���ȼ��廯�����ټ�1��1Ũ�����������Ҵ���
�������ٺ͢�ʵ��ʱ�����ﶼ��������ɫ�������Թ��м���______������ɱ�Ϊ��ɫ���뷽������Ƚϣ������ڵ�����ȱ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.0mol��L��1 NaOH��Һ�к�ijŨ��������Һʱ����pH������NaOH��Һ�������ϵ��ͼ��ʾ��ԭ������Һ�����ʵ���Ũ�Ⱥ���ȫ��Ӧ����Һ���������

A��1mol��L��1,60mL B��0.5mol��L��1,80mL
C��0.5mol��L��1,40mL D��1mol��L��1.80mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���3 mol A�����1 mol B�������ڹ̶��ݻ�Ϊ2 L���ܱ������У�������Ӧ��3A��g����B��g�� ![]() C��g����2D��s����2 minĩ�÷�Ӧ�ﵽƽ�⣬����D�����ʵ�����ʱ��ı仯�����ͼ��ʾ�������ж���ȷ���ǣ�������
C��g����2D��s����2 minĩ�÷�Ӧ�ﵽƽ�⣬����D�����ʵ�����ʱ��ı仯�����ͼ��ʾ�������ж���ȷ���ǣ�������
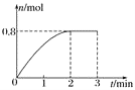
A. �����������ܶȲ��ٸı�ʱ���÷�Ӧ��һ���ﵽƽ��״̬
B. 2 min��ѹ��ʹ����Ӧ���ʼӿ죬�淴Ӧ���ʱ���
C. ��Ӧ������A��B��ת����֮��Ϊ3��1
D. ��ʼ��ƽ�⣬��A��ʾ�Ļ�ѧ��Ӧ����Ϊ0.3 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȤС�����ⶨijNaOH��Һ��Ũ�ȣ�������������£�
�ٽ���ʽ�ζ���������ˮϴ�����ô�����Һ��ϴ����ע�������Һ�����ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦����0���̶����µ�λ�ã����¶���������ƿ������ˮϴ�����ô�����Һ��ϴ��ƿ2��3�Σ��Ӽ�ʽ�ζ����зų�25.00mL������Һ����ƿ�С�
�ڽ���ʽ�ζ���������ˮϴ��������������ע��0.1000mol��L��1�����ᣬ���ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦����0���̶����µ�λ�ã����¶�����
������ƿ�е����̪��ָʾ�������еζ����ζ����յ㣬���������������ΪV1mL��
���ظ����Ϲ��̣����ڵζ�����������ƿ�м���5mL������ˮ�����������������ΪV2mL���Իش��������⣺
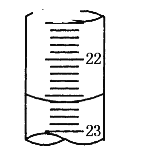
(1)�ζ��յ�ʱ������Ϊ��ƿ�е���Һ��______��
(2)�ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲�_______��
(3)��С���ڲ�����еĴ�����______���ɴ���ɵIJⶨ���________(����ƫ��������ƫ����������Ӱ����)��
(4)�����ȱ�ٵIJ�����_____��
(5)����ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ___mL��
(6)�����������ݣ�
�ⶨ���� | ����Һ���/mL | ���������/mL | |
�ζ�ǰ����/mL | �ζ������/mL | ||
��һ�� | 25.00 | 0.40 | 20.38 |
�ڶ��� | 25.00 | 4.00 | 24.02 |
���������ռ���Һ�����ʵ���Ũ�ȡ�(��д��������)_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Cu��Fe2O3�Ļ�����м���400 mL 1 mol��L��1�����ᣬǡ��ʹ�������ȫ�ܽ⣬������Һ�в���Fe3�������ù�����CO�ڸ����»�ԭ��ͬ������ԭ����������ٵ�����Ϊ
A. 2.4 g B. 3.2 g C. 4.8 g D. 6.4 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йذ��������в���ȷ����(����)
A. �������е�Ԫ�صĻ��ϼ�ֻ�����ߣ������л�ԭ��
B. ���Ĵ�������Ӧ�Ļ�ѧ����ʽ��4NH3��5O2![]() 4NO��6H2O
4NO��6H2O
C. ���Ĵ�������Ӧ���������������к���ɫ��������
D. ���Ĵ����������˹����Ĺ̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�װ��ͼ�������У�����ȷ���ǣ� ��
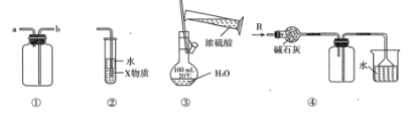
A.װ�âٿ������ռ�H2��CO2����
B.װ�â���X��Ϊ���Ȼ�̼�����װ�ÿ����������Ȼ��⣬����ֹ����
C.װ�âۿ�����ʵ��������һ�����ʵ���Ũ�ȵ�ϡ����
D.װ�âܿ����ڸ���ռ������������ն���İ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com