
| 17x+29y |
| x+y |
| m |
| n |
| m |
| M |
| 3mol |
| 1 |
| 17x+29y |
| x+y |
| m |
| n |
| 12.4g |
| 0.2mol |
| 28g |
| 56g/mol |
| 72g |
| 18g/mol |


科目:高中化学 来源: 题型:
| A、①②③ | B、③④⑤ |
| C、②④⑤ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铜
| ||||
B、铜
| ||||
C、铜
| ||||
D、铜
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=+890kJ?mol-1 | ||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ?mol-1 | ||
| C、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ?mol-1 | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过渡元素包括d、ds、f共三个区的元素,共中d区元素共包括六列六族 |
| B、在分子中碳原子形成双键,则该碳原子一定采取sp2杂化 |
| C、已知N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g),若该反应中有4 mol N-H键断裂,则形成的π键有2mol |
| D、植物光合作用所需的叶绿素是一种镁的配合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+的电子排布式:1s22s22p63s2 |
B、NH4Cl的电子式: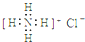 |
| C、乙烯的结构简式:C2H4 |
| D、氨气的空间结构:三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.9 g Na2O2固体中所含的离子数为0.15NA,所含的共价键数为0.05NA |
| B、14 g C2H4和C3H6的混合物中,所含H原子数为3NA |
| C、PCl3、NO2、BF3、HClO这些分子中每个原子都达到了8电子稳定结构 |
| D、电解精炼铜时,当阳极减少3.2 g铜时,转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
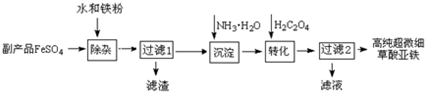
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com