
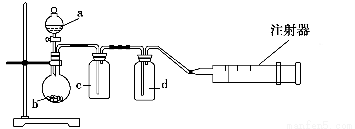
某课外活动兴趣小组欲用下列化学试剂在实验室里制取Cl2并验证Cl2的某些化学性质。实验试剂:3 mol·L-1 H2SO4、1 mol·L-1 NaOH溶液、MnO2、KMnO4、吸收少量SO2的NaOH溶液、浓盐酸、紫色石蕊试液、饱和NaCl溶液、BaCl2溶液、品红溶液。甲小组设计的实验装置图如下,在B中加入吸收少量SO2的NaOH溶液,D中加入1 mol·L-1 NaOH溶液。请回答下列问题:

Ⅰ.(1)写出仪器X的名称:________。
(2)写出A中发生反应的化学方程式:__________________________________,
不能用E装置代替A装置的原因是___________________________________。
(3)C装置的作用是_________________________________________________。
(4)甲小组通过该实验要验证Cl2的________(填“漂白性”、“还原性”或“氧化性”)。
(5)乙小组认为甲小组设计的实验装置有缺陷,请你帮助甲小组完善该装置。即还要在________和________(填“A”、“B”、“C”或“D”)装置间连接一个装有________的洗气装置。
Ⅱ.丙小组认为反应一段时间后,B装置溶液(强碱性)中肯定存在Cl-、OH-和SO,可能还含有其他的阴离子。
请你设计实验帮助丙小组探究该吸收液中可能存在的其他阴离子。
(1)提出合理假设
假设1:只存在________,或只存在________。
假设2:可能两者都________(填“存在”或“不存在”)。
(2)请设计实验验证假设的正确性:___________________________________。
Ⅰ.(1)分液漏斗
(2)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O KMnO4为易溶于水的粉末
(3)完全缓冲,防倒吸 (4)氧化性
(5)A B 饱和食盐水
Ⅱ.(1)ClO- SO32- 不存在
(2)取适量吸收液于两支试管中,向一支试管中加入足量盐酸,若产生能使品红溶液褪色的气体,则有SO32-;向另一支试管中加入盐酸,再加几滴紫色石蕊试液,若溶液先变红后褪色,则有ClO-(其他合理答案也可)
【解析】本题考查物质的制备及性质探究
Ⅰ.(1)仪器X是分液漏斗。(2)A是制备氯气的装置,用高锰酸钾与浓盐酸制备氯气不必加热,而用二氧化锰与浓盐酸制备氯气需要加热,所以A中发生的是高锰酸钾与浓盐酸的反应。高锰酸钾是粉末状固体,所以不能用E代替A。(3)C是缓冲瓶,起防倒吸的作用。(4)由于B中是吸收了少量SO2的NaOH溶液,即含有两种溶质:NaOH和Na2SO3。当氯气通入B溶液中时,氯气将其中的Na2SO3氧化,表现出氧化性。(5)浓盐酸有挥发性,挥发出的HCl气体会与B中溶质发生反应,对氯气与Na2SO3的反应产生干扰。
Ⅱ.(1)氯气与NaOH反应生成NaCl、NaClO,所以吸收液中可能含有ClO-。由于吸收液呈强碱性,所以氯气不足,SO32-可能有剩余。又由于ClO-与SO32-可发生氧化还原反应生成Cl-与SO42-,所以二者可能都没有剩余。(2)如果存在SO32-,加入足量稀盐酸会生成二氧化硫,二氧化硫能使品红溶液褪色;如果存在ClO-,加入足量稀盐酸会生成氯气,紫色石蕊试液遇氯气先变红后褪色。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K=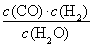 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为__________________________________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
A.v正(H2O)=v逆(H2)
B.容器中气体的平均相对分子质量不随时间改变
C.消耗n mol H2的同时消耗n mol CO
D.容器中物质的总物质的量不随时间改变
(3)该反应的v正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是________、________。
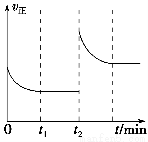
(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
下表为四种溶液的溶质质量分数和物质的量浓度的数值,根据表中数据判断四种溶液中密度最小的是( )。
溶液 | KOH | HNO3 | CH3COOH | HCl |
溶质质量分数w(%) | 56 | 63 | 60 | 36.5 |
物质的量浓度c(mol·L-1) | 14.3 | 13.8 | 10.6 | 11.8 |
A.HCl B.HNO3 C.CH3COOH D.KOH
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题15有机化学基础选考练习卷(解析版) 题型:填空题
已知某芳香族化合物A的水溶液显酸性,遇FeCl3不显色,可发生下列转化(如图所示)。其中I为五元环状化合物;J可使溴水褪色;I和J互为同分异构体;K和L都是医用高分子材料。

请回答下列问题。
(1)A的结构简式为______________。
(2)写出下列反应的反应类型:反应③属于________反应,反应④属于________反应。
(3)写出反应②和⑤的化学方程式。
②_______________________________________________________________,
⑤______________________________________________________________。
(4)写出符合下列要求的G的同分异构体______________________________。
①含有苯环;②能发生银镜反应,不能发生水解反应;③在稀NaOH溶液中,1 mol该同分异构体能与2 mol NaOH反应;④只能生成两种一氯代物。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题14物质结构与性质选考练习卷(解析版) 题型:填空题
我国已研制出一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为________。
(2)S与O为同主族元素,其中电负性较大的是________;H2S分子中S原子杂化轨道类型为________;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:____________。
(3)Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应可以生成NH2—NH2,NH2—NH2能否作配体?________(填“能”或“否”)。
②CaO晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含有Ca2+数为________;欲比较CaO与NaCl的晶格能大小,需考虑的数据是________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题12化学实验基础练习卷(解析版) 题型:选择题
用如图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是 ( )。
选项气体abcd
ASO2浓硫酸CuH2O浓硫酸
BCl2浓盐酸MnO2NaOH溶液浓硫酸
CNH3饱和
NH4Cl溶液消石灰空集气瓶固体NaOH
DNO稀硝酸铜屑H2O浓硫酸
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题12化学实验基础练习卷(解析版) 题型:选择题
下列实验操作正确的是 ( )。
A.中和滴定实验时,用待测液润洗锥形瓶
B.盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题11常见有机化合物及其应用练习卷(解析版) 题型:选择题
如图是常见四种有机物的比例模型示意图。下列说法正确的是 ( )。

A.甲能使酸性高锰酸钾溶液褪色
B.乙可与溴水发生取代反应使溴水褪色
C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的共价键
D.丁在稀硫酸作用下可与乙酸发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com