
分析 此题关键是计算142.2g油条中铝元素的质量,看是否大于0.004g.可先计算出142.2g油条中明矾的质量,再根据明矾中铝元素的质量分数计算铝元素的质量,然后和0.004g进行比较即可.
解答 解:明矾中铝元素的质量分数═$\frac{铝原子的相对原子质量×铝原子的个数}{明矾相对分子质量}$×100%,
因为每270g油条中约含0.9g明矾,所以142.2g油条中明矾的质量为$\frac{0.9g}{270g}$×142.2g=0.474g;
142.2g油条中铝元素的质量═0.474g×$\frac{27}{39+27+32×2+16×8+18×12}$×100%═0.027g
因为0.027g>0.004g
答:铝元素摄入量超过安全摄入量.
点评 本题考查了物质所含元素质量的计算,熟悉明矾的化学式及质量分数计算公式是解题关键,题目难度不大.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
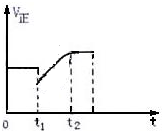 如图表示反应2SO2(g)+O2 $?_{加热}^{催化剂}$ 2SO3(g)+Q的正反应速率随时间的变化情况,试根据图曲线判断下列说法可能正确的是( )
如图表示反应2SO2(g)+O2 $?_{加热}^{催化剂}$ 2SO3(g)+Q的正反应速率随时间的变化情况,试根据图曲线判断下列说法可能正确的是( )| A. | t1时只减小了压强 | |
| B. | t1时只降低了温度 | |
| C. | t1时增加了SO2和O2的浓度,平衡向正反应方向移动 | |
| D. | t1时减小SO2浓度的同时,增加了SO3的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②④⑤ | C. | ①②④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在点燃易燃气体前,必须检验气体的纯度 | |
| B. | 浓酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸稀溶液 | |
| C. | 在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌 | |
| D. | 不得点燃添满酒精的酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层的电子数随核电荷数的增加而增多 | |
| B. | 单质颜色随核电荷数的增加而加深 | |
| C. | 氢化物的稳定性随核电荷数的增加而减弱 | |
| D. | 非金属性随核电荷数的增加而减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com