
分析 W、X、Y、Z是原子序数依次增大的4种短周期元素(稀有气体除外).其中只有X为金属元素,焰色反应为黄色,则X为Na;W的原子最外层电子数是其内层电子数的3倍,W只能有2个电子层,最外层电子数为6,则W为O元素;W、Y的原子最外层电子数相等,Y的原子序数较大,故Y为S元素;Z的原子序数最大,故Z为Cl元素,据此进行解答.
解答 解:W、X、Y、Z是原子序数依次增大的4种短周期元素(稀有气体除外).其中只有X为金属元素,焰色反应为黄色,则X为Na;且W的原子最外层电子数是其内层电子数的3倍,W只能有2个电子层,最外层电子数为6,则W为O元素;W、Y的原子最外层电子数相等,Y的原子序数较大,故Y为S元素;Z的原子序数最大,故Z为Cl元素,
(1)W为O元素,在元素周期表中的位置是:第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)X为Na,与水反应生成氢氧化钠与氢气,反应离子方程式是:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑.
点评 本题考查了位置、结构与性质的关系,题目难度中等,推断各元素为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题侧重考查学生的分析、理解能力及灵活应用能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 在热化学方程式中,物质化学式前面的化学计量数可以为整数也可以为简单分数 | |
| B. | 同一化学反应,热化学方程式中物质的化学计量数不同,反应的△H也不同 | |
| C. | 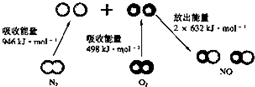 N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 | |
| D. | 化学反应中化学键的断裂和形成是反应过程中有能量变化的本质原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②④⑤⑥ | C. | ②④⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,活化分子百分数增大,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率可能增大 | |
| C. | 加入反应物,使活化分子百分数增大,化学反应速率增大 | |
| D. | 使用正催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2OH和 CH3CH(OH)CH3 | |
| B. | CH3CH(CH3)2和CH3CH2CH2CH3 | |
| C. | CH3CH2OH和CH3OCH3 | |
| D. | CH2=CHCH2CH2CH3和CH3CH2CH=CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com