
| A. | Cu丝 | B. | NaCl溶液 | C. | 熔融的NaOH | D. | 蔗糖 |
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | BaO2是离子化合物,但含有非极性共价键,晶体中阴阳离子个数相等. | |
| C. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| D. | 电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸银溶液生成白色沉淀,再加稀硝酸沉淀不溶解,则溶液中一定有Cl- | |
| B. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则溶液中一定有CO${\;}_{3}^{2-}$ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO${\;}_{4}^{2-}$ | |
| D. | 加入氢氧化钠溶液后生成白色沉淀,该白色沉淀迅速变成灰绿色,最终变成红褐色,则溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
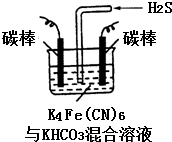 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中,元素所在的族序数等于原子的最外层电子数 | |
| B. | 同主族元素,随原子序数的增大,原子半径增大,主要原因是核电荷数增大 | |
| C. | 第二周期元素随原子序数的递增,元素原子的第一电离能依次递增 | |
| D. | 第 VIIA族元素从上到下,元素电负性逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3和NaHCO3的固体混合物,加热时有气体产生,加水溶解时有沉淀生成. | |
| B. | 25℃与60℃时,水的pH相等 | |
| C. | 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)不相等 | |
| D. | 2SO2(g)+O2(g)═2SO3(g)和 4SO2(g)+2O2(g)=4SO3(g)的△H相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 用醋酸除水垢:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | 用K37ClO3与浓盐酸制氯气:37ClO3-+6H++6Cl-═37Cl-+3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com