
| A. | 4molA+2molB | B. | 3molC+1molD+2molA+1molB | ||
| C. | 3molC+1molD+1molB | D. | 3molC+1molD |
分析 A.等效为在原平衡的基础上压强增大一倍到达的平衡状态,与原平衡相比平衡向逆反应方向移动;
B.等效为开始加入4molA+2molB,进一步等效为在原平衡的基础上压强增大一倍到达的平衡状态,与原平衡相比平衡向逆反应方向移动;
C.等效为开始加入2molA+2molB,相当于在原平衡的基础上在加入1molB,与原平衡相比平衡向正反应方向移动;
D.等效为开始加入2molA+1molB,与原平衡为完全等效平衡.
解答 解:A.等效为在原平衡的基础上压强增大一倍到达的平衡状态,与原平衡相比平衡向逆反应方向移动,C的物质的量减小大于混合气体总物质的量减小,故C的物质的量百分含量降低,故A错误;
B.等效为开始加入4molA+2molB,进一步等效为在原平衡的基础上压强增大一倍到达的平衡状态,与原平衡相比平衡向逆反应方向移动,C的物质的量减小大于混合气体总物质的量减小,故C的物质的量百分含量降低,故B错误;
C.等效为开始加入2molA+2molB,相当于在原平衡的基础上在加入1molB,平衡向正反应方向移动,故C的物质的量百分含量增大,故C错误;
D.等效为开始加入2molA+1molB,与原平衡为完全等效平衡,C的物质的量百分含量不变等于w,故D正确;
故选D.
点评 本题考查等效平衡、化学平衡影响因素等,难度中等,构建平衡建立的途径是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 2g氢气所含原子数目为NA | |
| C. | 1mol Al3+含有核外电子数为3NA | |
| D. | 17g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3COH的名称:1,1-二甲基乙醇 | B. | 有机物CH3CH=CHCH2OH的键线式为: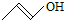 | ||
| C. | 乙醇分子的球棍模型: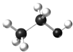 | D. | 氨基的电子式: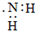 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该反应是置换反应 | |
| B. | Cl2是氧化剂 | |
| C. | Fe(OH)3发生还原反应 | |
| D. | 每生成1mol K2FeO4转移电子的物质的量为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用溴水或酸性KMnO4溶液都可鉴别乙烯和甲烷 | |
| B. | 在加热或加入重金属盐的情况下,蛋白质都可发生变性 | |
| C. | 液化石油气和天然气的主要成分都是甲烷 | |
| D. | 淀粉水解的最终产物是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com