
【题目】醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为:
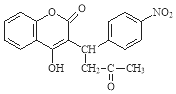
醋硝香豆素可以通过以下方法合成(部分反应条件省略)。

已知: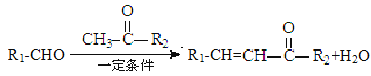
回答以下问题:
(1)反应①的反应类型是______。
(2)从A到B引入的官能团名称是______。
(3)物质C的结构简式为______。
(4)反应③的化学方程式为______。
(5)关于E物质,下列说法正确的是______(填字母序号)。
a 在核磁共振氢谱中有四组吸收峰
b 可以用酸性高锰酸钾溶液鉴别D和E
c 可以发生加成反应、聚合反应、氧化反应和还原反应
d 存在顺反异构
(6)分子结构中只含有一个苯环,且同时符合下列条件的G的同分异构体共有______种。
①可与氯化铁溶液发生显色反应;
②可与碳酸氢钠溶液反应生成二氧化碳气体。其中,苯环上的一氯代物只有两种的同分异构体的结构简式为______。
【答案】取代反应(或硝化反应) 溴原子 
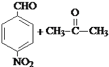
![]()
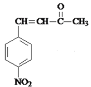 +H2O cd 13
+H2O cd 13 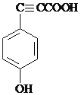
【解析】
甲苯和硝酸发生取代反应生成A,根据D的结构知,A结构简式为![]() ,B的结构简式为
,B的结构简式为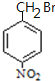 ,结合C相对分子质量知,C结构简式为
,结合C相对分子质量知,C结构简式为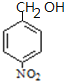 ,D和丙酮反应生成E,E结构简式为
,D和丙酮反应生成E,E结构简式为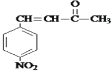 ,苯酚和丙二酸酐反应生成G,E和G反应生成醋酸香豆素,根据醋酸香豆素结构简式知,G结构简式为
,苯酚和丙二酸酐反应生成G,E和G反应生成醋酸香豆素,根据醋酸香豆素结构简式知,G结构简式为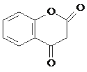 ,据此分析解答。
,据此分析解答。
(1)甲苯和硝酸发生取代反应生成A,根据D的结构知,A结构简式为![]() ,反应①为苯环上的氢原子被硝基取代;
,反应①为苯环上的氢原子被硝基取代;
(2)B的结构简式为 ,结合C相对分子质量知,C结构简式为
,结合C相对分子质量知,C结构简式为 ,A结构简式为
,A结构简式为![]() ,从A到B引入的官能团名称是溴原子;
,从A到B引入的官能团名称是溴原子;
(3)反应②的化学方程式为![]() ,C结构简式为
,C结构简式为 ;
;
(4)反应③的化学方程式为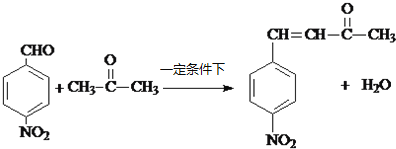 ;
;
(5)E为 ,
,
a.在核磁共振氢谱中有五组吸收峰,故错误;
b.E中含有碳碳双键、羰基、硝基,D中含有醛基、硝基,碳碳双键和醛基都能被酸性高锰酸钾溶液氧化,所以不可以用酸性高锰酸钾溶液鉴别D和E,故错误;
c.E中含有碳碳双键、羰基、硝基、苯环,可以发生加成反应、聚合反应、氧化反应和还原反应,故正确;
d.碳碳双键碳原子连接不同的支链,所以存在顺反异构,故正确;
(6)G为 ,分子结构中只含有一个环,G的同分异构体符合下列条件:
,分子结构中只含有一个环,G的同分异构体符合下列条件:
①可与氯化铁溶液发生显色反应,说明含有酚羟基;
②可与碳酸氢钠溶液反应生成二氧化碳气体,说明含有羧基,
如果取代基为-COOH、-C≡CH、-OH,
如果-COOH、-OH位于邻位,有4种同分异构体;
如果-COOH、-OH位于间位,有4种同分异构体;
如果-COOH、-OH位于对位,有2种同分异构体;
如果取代基为-C≡CCOOH、-OH,有邻间对三种结构;
所以有13种同分异构体;
且苯环上的一氯代物只有两种的同分异构体的结构简式为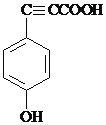 。
。
(1)甲苯和硝酸发生取代反应生成A,根据D的结构知,A结构简式为![]() ,反应①为苯环上的氢原子被硝基取代,反应①的反应类型是取代反应(或硝化反应),
,反应①为苯环上的氢原子被硝基取代,反应①的反应类型是取代反应(或硝化反应),
故答案为:取代反应(或硝化反应);
(2)B的结构简式为 ,结合C相对分子质量知,C结构简式为
,结合C相对分子质量知,C结构简式为 ,A结构简式为
,A结构简式为![]() ,从A到B引入的官能团名称是溴原子;故答案为:溴原子;
,从A到B引入的官能团名称是溴原子;故答案为:溴原子;
(3)反应②的化学方程式为![]() ,C结构简式为
,C结构简式为 ;故答案为:
;故答案为: ;
;
(4)反应③的化学方程式为 ,
,
故答案为: ;
;
(5)E为 ,
,
a.在核磁共振氢谱中有五组吸收峰,故错误;
b.E中含有碳碳双键、羰基、硝基,D中含有醛基、硝基,碳碳双键和醛基都能被酸性高锰酸钾溶液氧化,所以不可以用酸性高锰酸钾溶液鉴别D和E,故错误;
c.E中含有碳碳双键、羰基、硝基、苯环,可以发生加成反应、聚合反应、氧化反应和还原反应,故正确;
d.碳碳双键碳原子连接不同的支链,所以存在顺反异构,故正确;
故答案为:cd;
(6)G为 ,分子结构中只含有一个环,G的同分异构体符合下列条件:
,分子结构中只含有一个环,G的同分异构体符合下列条件:
①可与氯化铁溶液发生显色反应,说明含有酚羟基;
②可与碳酸氢钠溶液反应生成二氧化碳气体,说明含有羧基,
如果取代基为-COOH、-C≡CH、-OH,
如果-COOH、-OH位于邻位,有4种同分异构体;
如果-COOH、-OH位于间位,有4种同分异构体;
如果-COOH、-OH位于对位,有2种同分异构体;
如果取代基为-C≡CCOOH、-OH,有邻间对三种结构;
所以有13种同分异构体;
且苯环上的一氯代物只有两种的同分异构体的结构简式为 ,
,
故答案为:13; 。
。


科目:高中化学 来源: 题型:
【题目】金属在人类社会发展进程中发挥了重要作用,钠、镁、铝、铁、铜是最重要的几种金属。
(1)上述五种金属中人们发现并最早制得其单质的是_____________。
(2)这五种金属单质都具有的性质是_________________(填下列选项的序号)。
a.导电性 b.延展性 c.银白色 d.熔点高 e.硬度大
(3)钠、镁、铝、铁四种金属中,不能用于从氯化铜溶液中置换出铜的金属是_________,原因是 _________(用必要的化学方程式表示)。
(4)上述金属中,有一种金属的氧化物能在另一种金属的氢氧化物的水溶液中溶解,写出反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,沸点为-5.5℃,遇水和潮气分解。
回答下列问题:
(1)NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制C12,Cu和稀HNO3制NO。
①制取NO的离子方程式为________________________
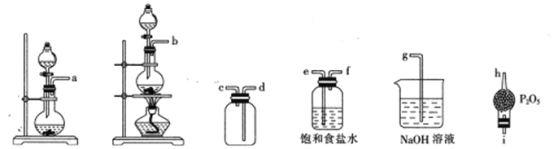
②选用下列部分装置预制备一瓶干燥纯净的氯气,各玻璃导管接口连接顺序为____(气流方向从左至右)。
(2)文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的原理及装置如下所示:
反应原理:NaNO2+2HCl=NOCl↑+NaCl+H2O。制取装置图:
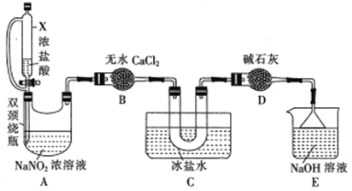
①仪器X的名称为_______,用它代替分液漏斗的优点是_________________
②装置C的U形管中观察到的现象是____________,装置D的作用是_________
(3)取少量产品NOCl滴入盛有水的试管中,液面上方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.聚氯乙烯分子能使溴水褪色
B.己烷共有4种同分异构体,它们的熔点、沸点各不相同
C.在一定条件下苯分别与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应
D.![]() 代表纯净物
代表纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
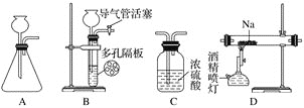
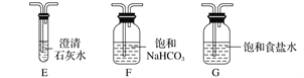
请回答下列问题:
(1)选择必要的仪器,按________顺序连接好装置(填装置序号)。
(2)检验装置B气密性的方法:_____________。
(3)实验时,在点燃酒精喷灯前必须进行的操作是________,待装置E中出现____现象时,再点燃酒精喷灯,以上操作的目的是____________。
(4)加热一段时间后观察到钠块表面变黑,继续加热后,钠燃烧,有白烟生成。两种产物中有一种是重要的化工原料,在玻璃工业中用量很大。则钠与二氧化碳反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是

A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力增强
B.铁在潮湿的环境下生锈以及Mg与NH4Cl溶液反应生成H2都与盐类水解有关
C.将Al2(SO4)3溶液加热、蒸干、灼烧,可得到固体Al2(SO4)3
D.将饱和FeCl3溶液滴入沸水中制胶体,离子方程式:Fe3++3H2O![]() Fe(OH)3(胶体) +3H+
Fe(OH)3(胶体) +3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁溶液可腐蚀印刷电路板.上的铜膜,某教师为了从腐蚀废液(含有大量FeCl3、FeCl2、CuCl2)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用。准备采用下列步骤:
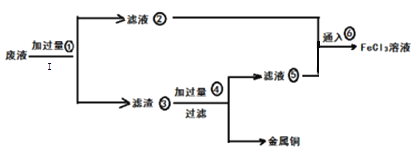
(1)步骤I的操作名称:_________________ :所需玻璃仪器:_______________________
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:__________________________________
(3)检验废腐蚀液中是否含有Fe3+所需试剂:______________________(填名称)
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:_______________________此转化的化学方程式为:___________________________________________________________
(5)写出③中所含物质:__________________(填化学式)⑥发生反应的离子方程式:________
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉。反应结束后,下列结果不可能出现的是_____(填写编号)
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A(g)+2B(g)![]() 2C(g),达到平衡状态的标志
2C(g),达到平衡状态的标志
A.A的分解速率和C的生成速率比为1:2
B.单位时间内生成n mol A的同时生成2n mol B
C.A、B的物质的量比为1:2
D.A、B、C的浓度不再发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com