
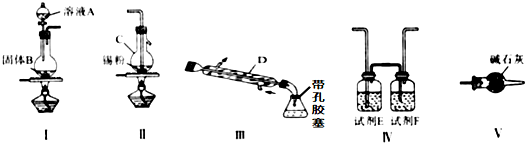
分析 由装置图可知装置Ⅰ应为制备氯气装置,离子反应为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,Ⅳ中试剂E为饱和食盐水除去HCl,可以降低氯气的溶解,试剂F为浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在装置Ⅱ中反应生成SnCl4,Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,反应生成SnCl4,经冷却后在装置Ⅲ中收集,未反应的氯气,用装置Ⅴ中的碱石灰吸收,同时碱石灰还可以防止空气中水分进入装置Ⅲ中使产物水解,以此解答该题.
解答 解:(1)由装置图可知仪器C为蒸馏烧瓶;仪器D的作用是将SnCl4气体冷凝为液体,从而收集下来,
故答案为:蒸馏烧瓶;将SnCl4气体冷凝为液体;
(2)该实验中先制备氯气,氯气经除杂,干燥后与锡在装置Ⅱ中反应生成SnCl4,经冷却后在装置Ⅲ中收集,因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅲ中,所以连接顺序是I→Ⅳ→Ⅱ→Ⅲ→V;
故答案为:I;Ⅳ;Ⅱ;Ⅲ;V;
(3)装置Ⅰ中制得的氯气中含有氯化氢和水蒸气,装置E为饱和食盐水,除去氯化氢,装置F为浓硫酸,除去水蒸气;因SnCl4极易水解,应防止空气中的水蒸气进入装置Ⅲ中,通过连接装置V来实现,
故答案为:饱和食盐水;浓硫酸;防止四氯化锡与空气中的水反应或吸收未反应的氯气;
(4)①有气体参与的反应,为保证实验的顺利进行,需检查装置的气密性,
故答案为:检查装置的气密性;
②实验开始时先要用氯气将装置中空气排尽,防止空气中的水分对产物的影响,所以先点燃Ⅰ处的酒精灯,后点燃II处的酒精灯进行实验,
故答案为:I;II;
(5)若Ⅱ中用去锡粉5.95g,则n(Sn)=$\frac{5.95g}{119g/mol}$=0.05mol,理论上产生的SnCl4的物质的质量是m(SnCl4)=0.05mol×261g/mol=13.05g,所以反应后,Ⅲ中锥形瓶里收集到12.0gSnCl4,则SnCl4的产率为$\frac{12.0g}{13.05g}$×100%=92.0%,
故答案为:92.0%.
点评 本题考查物质的制备,涉及仪器的识别、实验操作的目的、盐类水解、物质产率的计算等知识,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质设计实验步骤,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 生物酶固氮相比人工固氮更高效、条件更温和 | |
| B. | 透过观察颜色容易区分黄金与铜锌合金 | |
| C. | 近日用地沟油炼制的生物航油载客首飞,标志着我国航空业在节能减排领域进入商业飞行阶段 | |
| D. | 尿液燃料电池的原理是在微生物作用下将尿液中的有机物转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯固定的熔沸点,其可由乙烯通过加聚反应合成 | |
| B. | 有机物的种类繁多,分子中含有碳、氢元素的物质即为有机物 | |
| C. | 石油的分馏和煤的干馏均属于物理变化 | |
| D. | 不是所有的有机物中都含有一种或多种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +(2n-1)H2O
+(2n-1)H2O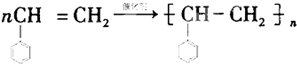
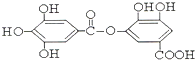 与NaOH的反应
与NaOH的反应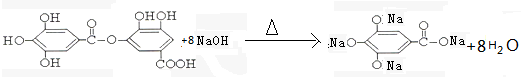
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
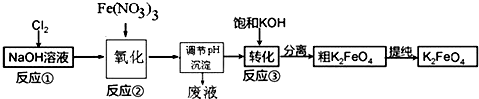

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
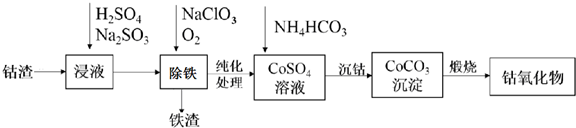
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | AB的消耗速率等于A2的消耗速率 | |
| C. | 容器内,3种气体AB、A2、B2共存 | |
| D. | 容器中各组分的体积分数不随时间变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com