
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
分析 (1)反应是吸热反应,反应前后气体体积增大,结合平衡移动原理分析判断转化率;
(2)相同条件下压强之比等于物质的量之比,反应前后物质的量的增大是反应的A的物质的量,结合转化率概念计算得到;依据化学平衡三段式列式计算平衡浓度达到平衡常数;
( 3 ) 依据相同条件下压强之比等于物质的量之比,结合平衡计算得到;
解答 解:(1)在一定温度进行如下反应:A(g)?B(g)+C(g )△H=+85.1kJ•mol-1
反应是吸热反应,反应前后气体体积增大,根据平衡移动原理分析可知,欲提高A的平衡转化率,平衡正向进行,可以升温或减压条件下使平衡正向进行;
故答案:升高温度、降低压强;
(2)反应前后气体物质的量增大为反应的A的量,所以由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式=$\frac{P-{P}_{0}}{{P}_{0}}$×100%=(
$\frac{P}{{P}_{0}}$-1)×100%;
平衡时A的转化率=$\frac{9.53-4.91}{4.91}$×100%=94.1%,
A(g)?B(g)+C(g )
起始量(mol/L) 0.10 0 0
变化量(mol/L) 0.10×94.1% 0.10×94.1% 0.10×94.1%
平衡量(mol/L)0.10(1-94.1%) 0.10×94.1% 0.10×94.1%
K=$\frac{c(B)c(C)}{c(A)}$=$\frac{(0.0941mol/L){\;}^{2}}{0.10×(1-94.1%)}$=1.5mol/L
故答案为:($\frac{P}{{P}_{0}}$-1)×100%;94.1%;1.5mol/L;
(3))①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),依据压强之比等于物质的量之比,n总:n起始=P:P0 ,n总=$\frac{0.10P}{{P}_{0}}$;
A(g)?B(g)+C(g )
起始量(mol) 0.10 0 0
变化量(mol) x x x
某时刻量(mol) 0.10-x x x
(0.10+x):0.10=P:P0
x=$\frac{0.10(P-{P}_{0})}{{P}_{0}}$;
n(A)=0.10-$\frac{0.10(P-{P}_{0})}{{P}_{0}}$=0.10×(2-$\frac{P}{{P}_{0}}$)mol;
故答案为:$\frac{0.10P}{{P}_{0}}$;0.10×(2-$\frac{P}{P0}$).
点评 本题考查压强关系和物质的量的计算应用,化学平衡计算方法,图表数据处理方法的分析判断,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
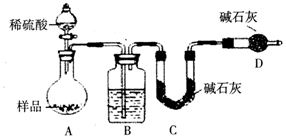
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),是常用的解热镇痛药,实验室合成流程如下:
),是常用的解热镇痛药,实验室合成流程如下:

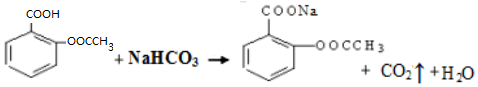 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO3)/mol | n(O2)/mol |
| 0 | 2.0 | 0 |
| 2 | 0.8 | |
| 4 | 0.6 | |
| 6 | 1.8 | 1.1 |
| A. | 0~2 min平均速率v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 4 min后,平衡移动的原因可能是减压 | |
| C. | 若升高温度后的平衡常数的值为1.0,则该正反应为吸热反应 | |
| D. | 若起始时容器中SO3的物质的量改为1.0 mol,则平衡时n(SO2)=0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
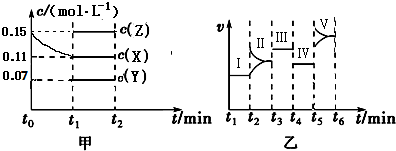
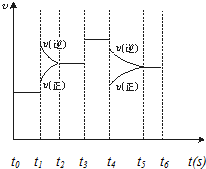 在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),如图是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),如图是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 电池的总反应是 2C4H10+13O2=8CO2+10H2O | |
| C. | 通入空气的一极是正极,电极反应为 O2+4e-=2O2- | |
| D. | 通入丁烷的一极是负极,电极反应为 C4H10+13O2-+26e-=4CO2+5H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com