

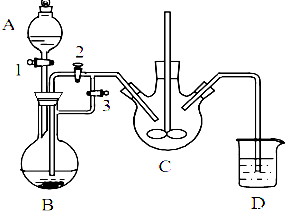
分析 从海水中提取金属镁的流程:把贝壳制成石灰乳操作①,在引入的海水中加入石灰乳,将海水中含有的镁离子转化为氢氧化镁沉淀,反应方程式为:Mg2++2OH-=Mg(OH)2↓,然后将氢氧化镁溶于盐酸中操作②得到氯化镁溶液,反应方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,用氯化镁溶液在氯化氢氛围中制取无水氯化镁,活泼金属采用电解其熔融盐的方法冶炼,镁是活泼金属,最后利用电解熔融氯化镁的方法冶炼镁操作③,反应方程式为MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(1)在海水中加入氧化钙,氧化钙和水反应生成氢氧化钙,氢氧化钙和海水中的氯化镁发生复分解反应生成氢氧化镁;从液体中得到沉淀氢氧化镁用过滤的方法分离,从溶液中析出固体采用蒸发结晶的方法得到;
(2)利用盐酸溶解氢氧化镁不引入其它杂质离子;
(3)生成的Mg(OH)2中含有少量Ca(OH)2,可以利用氢氧化镁溶解性小,加入氯化镁溶液洗涤过滤除去;
解答 解:(1)在海水中加入氧化钙发生反应:CaO+H2O═Ca(OH)2;氢氧化钙和海水中的氯化镁发生复分解反应:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,氢氧化镁是难溶性的固体,将不溶性的固体和溶液分离的方法是过滤,所以操作①主要是指过滤,操作②是从溶液中析出固体,采用蒸发浓缩,冷却结晶,过滤洗涤的方法得到MgCl2•6H2O,
故答案为:过滤,蒸发浓缩、冷却结晶;
(2)加入试剂①时所发生反应是将氢氧化镁溶于盐酸中得到氯化镁溶液,不引入其它杂质阴离子,所以试剂①为盐酸,反应的离子方程式为:Mg(OH)2+2H+═Mg2++2H2O,
故答案为:Mg(OH)2+2H+═Mg2++2H2O;
(3)如果生成的Mg(OH)2中含有少量Ca(OH)2,加入氯化镁溶液,Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,过滤得到氢氧化镁沉淀,除去氢氧化钙,
故答案为:MgCl2溶液;
点评 本题考查了镁的提取,掌握从海水中提取金属镁的流程:先将海水中含有的镁离子转化为氢氧化镁沉淀,然后将氢氧化镁溶于盐酸中得到氯化镁溶液,用氯化镁溶液制取无水氯化镁,最后利用电解熔融氯化镁的方法冶炼镁,是解答的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M只能是碱类 | B. | M只能是盐类 | C. | M一定为电解质 | D. | M可能为非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)减小 | B. | c(CH3COO-) 增大 | ||
| C. | pH减小 | D. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A. | 在冰醋酸中,高氯酸的酸性最强 | |
| B. | 水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱 | |
| C. | 在冰醋酸中1mol/L的高氯酸的电离度约为0.4% | |
| D. | 在冰醋酸中硫酸的电离方程式为:H2SO4═2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A+3B═2C | B. | A+3B═2C | C. | 3A+B═2C | D. | 3A+2B═3C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下不容易与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 浓硫酸在常温下能够使铁、铝、锌等金属钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com