
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,8gO2含有8NA个质子
B.分子总数为NA的CO2和NO2混合气体中含有的氧原子数为2NA
C.标准状况下,22.4L盐酸含有NA个HC1分子
D.分子总数为NA的CO、N2混合气体体积约为22.4L,质量为28g
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某同学在实验室纯盐的流程如下:

请回答:
(1)步骤③、⑤的操作名称是_______、_______。
(2)粗盐中含有![]() 、
、![]() 、
、![]() 等杂质离子,步骤②所用的除杂试剂有:①碳酸钠溶液;②氯化钡溶液;③氢氧化钠溶液,则加入试剂的顺序_______(填编号)。
等杂质离子,步骤②所用的除杂试剂有:①碳酸钠溶液;②氯化钡溶液;③氢氧化钠溶液,则加入试剂的顺序_______(填编号)。
a.②③① b.①②③ c.③②① d.③①②
(3)除杂过程中,加入![]() 溶液的目的是_____________。
溶液的目的是_____________。
(4)步骤④判断加入的盐酸“适量”的方法是______________________,步骤⑤加热时要用玻璃棒搅拌,这是为了防止________,加热到_________时,停止加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-、碳氢化合物大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s)+O2(g)=2CO(g) △H2=-221kJ/mol K2(同上)
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式_________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L密闭容器中充入0.lmolNO2和02m1CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2)=_________mol/(L·s)。
②若容器中观察到____________________________,可判断该反应达到平衡状态;
③能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
(3)电化学降解NO2-的原理如图:

阴极反应式为_____________________________________。
(4)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图。活化能最小的是________[用E(A)、E(B)、E(C)表示三种催化剂下该反应的活化能]。

②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图。试说明图中曲线先增大后减小的原因____________________________________________________(假设该温度范围内催化剂的催化效率相同)。
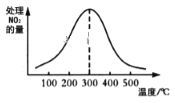
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+。对于该平衡,下列叙述正确的是
CH3COO-+H+。对于该平衡,下列叙述正确的是
A. 加入少量NaOH固体,平衡向正反应方向移动
B. 加水,平衡向逆反应方向移动
C. 滴加少量0.1mol/LHCl溶液,溶液中c(H+)减少
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出以下反应的化学反应方程式
①三氧化二铁与稀硫酸反应:______
②氢氧化铝药物治疗胃酸(主要成分为盐酸)过多:______
③氢氧化钠溶液吸收少量二氧化硫气体:______
(2)已知CO和CO2的混合气体18.0g在标准状况下所占的体积为11.2L。则该混合气体中,CO2的物质的量为____mol。
(3)在同温同压下,若A容器中的O2和B容器中的SO2所含的氧原子总数相等,则A容器和B容器的体积比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A和G均为气体,其中A为黄绿色。C和D均为酸,其中C具有漂白性。E和I均为常见金属,其中I为紫红色。

⑴气体A所含元素在周期表中的位置是:______。D的电子式为______。
⑵写出反应①的离子方程式:______。
⑶写出反应④的化学方程式,并用单线桥表示电子转移的方向和数目:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子[-lgc(M2+)]与溶液pH的变化关系如a、b所示,已知:该温度下Kap[Cu(OH)2]<Kap[Fe(OH)2]下列说法中正确的是
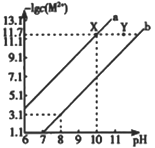
A. a线表示Fe(OH)2饱和溶液中的变化关系
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6:1
C. 除去CuSO4溶液中少量的Fe2+,可加入适量CuO
D. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是

A. XOH是弱碱
B. pH=10的溶液中c(X+):XOH大于X2CO3
C. 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D. 当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且c(HCO3-)/c(CO32-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com