
【题目】下列离子组一定能大量共存的是
A.能使pH试纸显红色的溶液中:Na+、NH4+、I-、NO3-
B.含有0.1 mol/LFe3+ 的溶液中:K+、Mg2+、S2-、SO42-
C.由水电离出来的c(H+) = 1×10-13 mol/L的溶液中:K+、CO32-、Cl-、NO3-
D.常温下,![]() 的溶液:Na+、K+、CO32-、NO3-
的溶液:Na+、K+、CO32-、NO3-
科目:高中化学 来源: 题型:
【题目】对如图装置(铁的防护)的分析正确的是( )
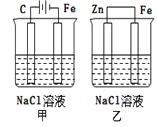
A.甲装置是牺牲阳极的阴极保护法
B.乙装置是牺牲阳极的阴极保护法
C.一段时间后甲、乙装置中pH均增大
D.甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O![]() CH3COOH+C2H5OH。已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是
CH3COOH+C2H5OH。已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是

A. 图中A、B两点表示的c(CH3COOC2H5)相等
B. 反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
C. 图中t0时说明反应达到平衡状态
D. 图中tB时CH3COOC2H5的转化率等于tA时的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 对2NO2(g)![]() N2O4(g) △H<0, 升高温度平衡体系颜色变深
N2O4(g) △H<0, 升高温度平衡体系颜色变深
D. SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2 ![]() CO+H2O的平衡常数表达式为K==
CO+H2O的平衡常数表达式为K==![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
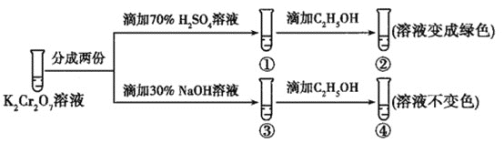
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.澄清石灰水与过量的小苏打溶液反应:![]()
B.往明矾溶液中加入氢氧化钡溶液至Al3+完全沉淀: A13++2SO42-+2Ba2++3OH-![]() A1(OH)3↓+2BaSO4↓
A1(OH)3↓+2BaSO4↓
C.向NaHSO4溶液中滴加![]() 至刚好沉淀完全:
至刚好沉淀完全:![]() ↓
↓![]()
D.向含有0.1 mol溶质的FeI2溶液中通入0.1 mol的Cl2:2I— +Cl2![]() I2+2Cl--
I2+2Cl--
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) ![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )

A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
C. 25 ℃时,该反应的平衡常数K=2.2
D. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用Pt电极电解1 L浓度均为0.1 mol·L-1的HCl、CuSO4的混合溶液,装置如图,下列说法正确的是( )
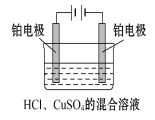
A.电解开始时阴极有H2放出
B.电解开始时阳极上发生:Cu2++2e-Cu
C.整个电解过程中,SO42-不参与电极反应
D.当电路中通过电子的量超过0.1 mol时,此时阴极放电的离子发生了变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com