
| A. | 氯气:K+、Na+、AlO2-、CO32- | B. | 二氧化硫:Na+、NH4+、SO32-、Cl- | ||
| C. | 氯化氢:H+、K+、MnO4-、SO42- | D. | 二氧化碳:Mg2+、Al3+、Cl-、NO3- |
分析 A.氯气与水反应生成酸;
B.二氧化硫与SO32-反应;
C.H+、Cl-、MnO4-发生氧化还原反应;
D.该组离子之间不反应,且与二氧化碳不反应.
解答 解:A.氯气与水反应生成酸,不能大量存在AlO2-、CO32-,故A不选;
B.二氧化硫与SO32-反应,不能大量共存,故B不选;
C.H+、Cl-、MnO4-发生氧化还原反应,不能大量共存,故C不选;
D.该组离子之间不反应,且与二氧化碳不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
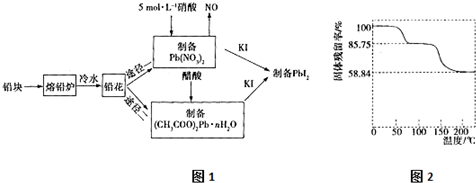
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A. | 甲的金属性比乙强 | B. | 乙的化合价为+1价 | ||
| C. | 丙一定为非金属元素 | D. | 丁一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.3 | B. | 9.7 | C. | 10.3 | D. | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将Cl2通入NaOH溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 铜和稀硝酸的反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 钢铁吸氧腐蚀的正极反应:4OH--4e-═O2↑+2H2O | |
| D. | 将少量SO2通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
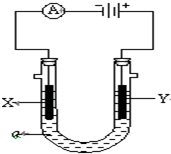 电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com