



 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
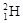 和
和 组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。
组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。 2-微粒的结构示意图: 。
2-微粒的结构示意图: 。 MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。
MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3:2:2 | B.3:3:1 | C.1:3:3 | D.1:2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 的浓硫酸的体积为:__________mL(计算
的浓硫酸的体积为:__________mL(计算查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ×100% ②C=
×100% ②C= ③上述溶液中再加入VmL水后,所得溶液的质量分数大
③上述溶液中再加入VmL水后,所得溶液的质量分数大| A.②④ | B.②③ | C.①③ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA |
| B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA |
| C.50 mL 12 mol?L-1浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D.常温常压下,46g NO2 与N2O4的混合气体中含有的原子总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com