
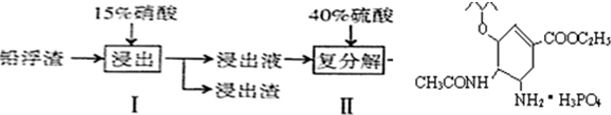
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
| A、步骤I有NO产生,浸出液中含量最多的金属阳离子为Pb2+ |
| B、步骤I需控制硝酸的用量并使Pb稍有剩余,其目的是防止Ag被溶解进入溶液 |
| C、母液可循环利用于步骤I,其溶质主要是Pb(NO3)2 |
| D、产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去CaSO4 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
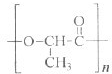
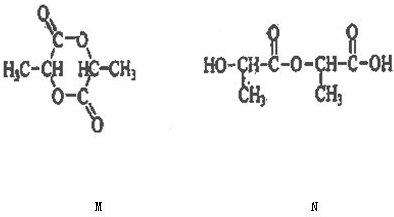
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原 |
| B、在101KPa下,1mol物质完全燃烧的反应热叫做该物质的热值 |
| C、在化合物中,不是电解质就是非电解质 |
| D、对于可逆反应,温度升高则该反应的平衡常数一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用乙醇或CCl4均可提取碘水中的碘单质 |
| B、NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| D、24Mg32S晶体中电子总数与中子总数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发生化学反应时失去电子越多的金属原子,还原能力越强 |
| B、金属阳离子被还原后,一定得到金属的单质 |
| C、电离时能生成H+的化合物一定是酸 |
| D、能与酸反应的氧化物,不一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阿伏加德罗常数是一个纯数,没有单位 |
| B、阿伏加德罗常数就是6.02×1023 |
| C、阿伏加德罗常数是指1mol的任何粒子的粒子数 |
| D、阿伏加德罗常数的值为:6.02×1023mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com