
分析 (1)依据用固体配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(2)依据m=CVM计算需要氯化钠的质量;
(3)依据用固体配制一定物质的量浓度溶液的一般步骤排序;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)用固体配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,配制100mL 2mol/L NaCl溶液,应选择100mL容量瓶,所以还缺少的仪器:100 mL容量瓶;
故答案为:100 mL容量瓶;
(2)配制100mL 2mol/L NaCl溶液,需要溶质的质量为:0.1L×2mol/L×58.5g/mol=11.7g;
故答案为:11.7;
(3)用固体配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,所以正确的操作步骤为:
①③⑤②④;
故答案为:①③⑤②④;
(4)如果实验过程中缺少步骤⑤,会造成部分溶质损耗,溶质的物质的量偏小,所配溶液的物质的量浓度 偏低;
若定容时俯视容量瓶刻度线,会造成所配溶液的体积偏小,溶液的物质的量浓度 偏高;
故答案为:偏低; 偏高.
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确配制原理及操作步骤是解题关键,注意误差分析的方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 比例模型为 ,可以表示甲烷分子,也可以表示四氯化碳分子 ,可以表示甲烷分子,也可以表示四氯化碳分子 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 二氧化硫、氨、煤的液化均为物理变化 | |
| D. | 实验室中制取乙酸乙酯的方程式为CH3COOH+H18O-C2H5CH3COOC2H5+H218O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 细颗粒 | 2.00 |
| ② | 常温 | 细颗粒 | 1.00 |
| ③ | 35℃ | 粗颗粒 | 2.00 |
| ④ | 35℃ | 细颗粒 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中MnO2是氧化剂 | |
| B. | 氧化产物与还原产物物质的量之比为1:3 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| C. | NaHCO3溶液中溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 室温下,对于0.10 mol•L-1的氨水,加水稀释后,溶液中c(NH4+)•c(OH-)变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 溴苯(溴单质) | 苯 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
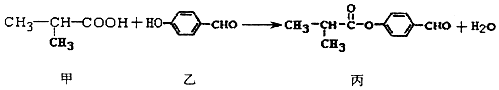
| A. | 丙的分子式为C11H11O3 | |
| B. | 甲分子中含有1个手性碳原子 | |
| C. | 乙、丙各lmol分别和氢气反应,最多消耗氢气均为4mol | |
| D. | 丙可发生加成反应、取代反应、氧化反应等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 NaHNa+[:H]- CsOH
NaHNa+[:H]- CsOH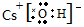 HSCN
HSCN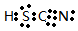 O22-
O22- .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用蒸馏水 | B. | 使用NaHCO3溶液 | ||
| C. | 使用CuSO4和NaOH溶液 | D. | 使用pH试纸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com