
已知分解1mol MgCO3固体吸热112.2kJ,它的热化学方程式为( )
A.MgCO3(s)=MgO(s)+CO2(g);△H=+112.2 kJ·mol-1
B.MgCO3(s)=MgO(s)+CO2(g);△H=+112.2 kJ·mol-1
C.MgCO3(s)=MgO(s)+CO2(g);△H=-112.2 kJ·mol-1
D.MgCO3(s)=MgO(s)+CO2(g);△H=-112.2 kJ·mol-1
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
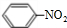
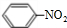
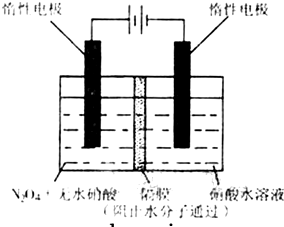
| t/s | 0 | 500 | 1000 |
| e(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
 或
或
 或
或

| ||
| 冰晶石 |
| ||
| 冰晶石 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.
含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
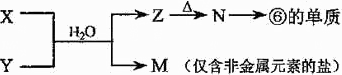
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com