
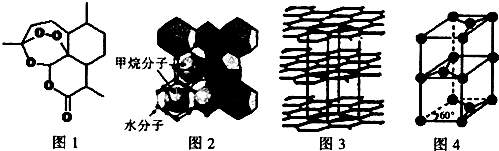
分析 (1)Cu原子核外电子数为29,原子核外电子排布式为1s22s22p63s23p63d104s1,失去4s能级1个电子、3d能级2个电子形成Cu3+;
(2)构成化合物的阳离子有未成对电子时,该化合物具有磁性,适合作录音磁带磁粉原料,根据离子核外电子排布式判断;
(3)青蒿素的组成元素有C、H、H,非金属性越强电负性越大;分子中酯基中C原子为形成3个σ键、其它碳原子形成4个σ键,均没有孤对电子;
(4)①水分子之间形成氢键,分子之间还存在范德华力;
②H2O分子中O原子形成2个σ键、含有2对孤电子对;孤对电子与成键电子的排斥力比成键电子之间排斥力大;
(5)根据均摊法计算晶胞中C原子数目,C-C键长为b pm,则上、下底面为菱形,上底面棱长为b pm×$\frac{\sqrt{3}}{2}$×2=$\sqrt{3}$b pm,石墨的层间距为apm,则晶胞高为2a pm,计算晶胞质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)Cu原子核外电子数为29,原子核外电子排布式为1s22s22p63s23p63d104s1,处于周期表中第四周期第ⅠB族,失去4s能级1个电子、3d能级2个电子形成Cu3+,基态Cu3+的核外电子排布式为1s22s22p63s23p63d8,
故答案为:第四周期第ⅠB族;1s22s22p63s23p63d8;
(2)A.V2O5 中V5+的核外电子排布式为1s22s22p63s23p6,没有未成对电子,没有磁性;
B.CrO2 中Cr4+的核外电子排布式为1s22s22p63s23p63d2,有未成对电子,具有磁性;
C.PbO 中Pb处于IVA族,失去p能级2电子形成Pb2+,没有未成对电子,没有磁性;
D.ZnO中Zn2+的核外电子排布式为1s22s22p63s23p63d10,没有未成对电子,具有磁性,
CrO2适合作录音磁带磁粉原料,
故选:B;
(3)青蒿素的组成元素有C、H、H,非金属性越强电负性越大,故电负性O>C>H;分子中酯基中C原子为形成3个σ键、其它碳原子形成4个σ键,均没有孤对电子,碳原子的杂化方式为 sp2、sp3,
故答案为:O>C>H;sp2、sp3;
(4)①水分子之间形成氢键,分子之间还存在范德华力,故答案为:氢键、范德华力;
②H2O分子中O原子形成2个σ键、含有2对孤电子对,VSEPR模型为四面体形;甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小,则键角H2O<CH4,
故答案为:四面体形;<;甲烷分子的杂化轨道中无孤电子对,而H2O分子有两对孤对电子,孤对电子与成键电子的排斥力大、键角小;
(5)根据均摊法,晶胞中C原子数目=1+8×$\frac{1}{8}$+4×$\frac{1}{4}$+2×$\frac{1}{2}$=4,晶胞质量为$\frac{4×12}{N{\;}_{A}}$g,C-C键长为b pm,则上、下底面为菱形,上底面棱长为b pm×$\frac{\sqrt{3}}{2}$×2=$\sqrt{3}$b pm,石墨的层间距为apm,则晶胞高为2a pm,则晶胞密度为$\frac{4×12}{N{\;}_{A}}$g÷{[2×$\frac{1}{2}$×$\sqrt{3}$b×10-10×$\sqrt{3}$b×10-10×sin60°cm]×2a×10-10cm}=$\frac{16×10{\;}^{30}}{\sqrt{3}ab{\;}^{2}N{\;}_{A}}$g.cm-3,
故答案为:4;$\frac{16×10{\;}^{30}}{\sqrt{3}ab{\;}^{2}N{\;}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、杂化方式、价层电子对互斥理论、晶胞计算等,(5)为易错点、难点,需要学生具备一定的空间想象与数学计算能力,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 海水含镁,将金属钠放入海水中可以制取金属镁 | |
| B. | 从海水中提取溴的过程涉及氧化还原反应 | |
| C. | 利用海水制取精盐不涉及化学反应 | |
| D. | 海底多金属结核矿含有Fe、Mn、Co、B等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
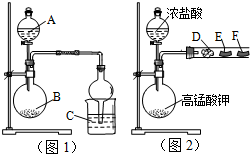 某研究性学习小组设计了两组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,D、E、F三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸条.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了两组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,D、E、F三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸条.已知常温下浓盐酸与高锰酸钾能反应生成氯气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加稀NaOH溶液反复洗涤、分液 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓硝酸和浓硫酸,将其倒入NaOH溶液中,静置,分液 | |
| D. | 乙烯中混有SO2和CO2,将其通入NaOH溶液洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①④⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、NaClO、Na2O | B. | HCl、HClO、MgCl2 | ||
| C. | NH3、CO2、Na2O2 | D. | C2H6、H2O2、C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL碱式滴定管准确量取22.00 mL KMnO4溶液 | |
| B. | 用广泛pH试纸测出某盐酸的pH为3.2 | |
| C. | 使用pH试纸测定溶液pH时先润湿,则测得溶液的pH都偏小 | |
| D. | 实验室配制FeCl3溶液:先将FeCl3溶解在盐酸中,再加水稀释到所需要的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com