
| A. |  2-乙基丙烷 | B. | 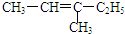 3-甲基-3-戊烯 | C. | 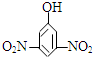 2,4-二硝基苯酚 | D. | 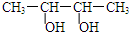 2,3-丁二醇 |
分析 A、烷烃命名中出现2-乙基,说明选取不是最长碳链;
B、烯烃命名选取距离碳碳双键最近一端为1号碳;
C、羟基所在位置为1号碳,据此命名芳香烃的衍生物;
D、醇类命名选取含有羟基最多的为主链.
解答 解:A、 ,最长碳链为4,正确命名为2-甲基丁烷,故A错误;
,最长碳链为4,正确命名为2-甲基丁烷,故A错误;
B、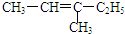 ,含有双键的最长碳链为5,碳碳双键位于23号碳之间,正确命名为:3-甲基-2-戊烯,故B错误;
,含有双键的最长碳链为5,碳碳双键位于23号碳之间,正确命名为:3-甲基-2-戊烯,故B错误;
C、 ,羟基所在的碳为1号碳,硝基分别处于3、5号碳上,正确命名为:3,5-二硝基苯酚,故C错误;
,羟基所在的碳为1号碳,硝基分别处于3、5号碳上,正确命名为:3,5-二硝基苯酚,故C错误;
D、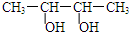 ,为二醇,最长碳链为4,正确命名为:2,3-丁二醇,故D正确,
,为二醇,最长碳链为4,正确命名为:2,3-丁二醇,故D正确,
故选D.
点评 本题主要考查的是烷烃、烯烃以及多元醇和芳香烃衍生物的命名,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2作为氧化剂得到的电子数为NA | |
| B. | 在25℃,101kPa时,22.4L氢气中含有2NA个氢原子 | |
| C. | 14g氮气中含有7NA个电子 | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:LiOH>NaOH>KOH | |
| B. | 熔点:I2>Br2>Cl2 | |
| C. | 热稳定性:HF>HCl>HBr | |
| D. | 若X2-的核外电子数目为18,则元素X在第三周期ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
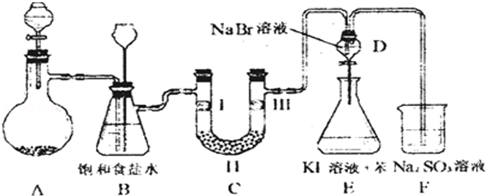
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符号 | ② | ③ | ④ | ⑤ |
| 原子半径 | 130 | 118 | 75 | 73 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
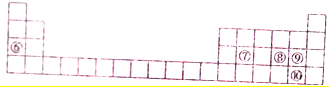
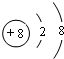 ;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)
;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com