
【题目】水钴矿的主要成分为Co2O3,还含SiO2及少量Al2O3、Fe2O3、 CuO、MnO2等。一种利用水钴矿制取CoCl2·6H2O 的工艺流程如下:
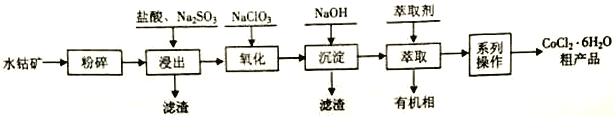
已知: ①CoCl2·6H2O受热易失去结晶水。
②25 ℃时,设定溶液中某金属离子初始浓度为0.1 molL-1,部分沉淀的参考数据如下表(“沉淀完全”指溶液中该离子浓度≤1.0×10-5molL-1):
沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.4 | 1.5 | 6.3 | 7.0 | 4.7 | 8.1 |
沉淀完全时pH | 4.7 | 2.8 | 8.3 | 9.0 | 6.7 | 10.1 |
回答下列问题
(1)计算25℃时Co(OH)2的Ksp =_______________。
(2)浸出工序中加入一定量的Na2SO3还原Co2O3、MnO2等,Co2O3发生反应的离子方程式为_______________________________。
(3)氧化工序要控制NaClO3用量,若不慎加入过量NaClO3,可能生成的有毒气体是______________;氧化工序主要反应的离子方程式为_______________________________。
(4)已知温度对铜、钴、铁的浸出率的影响如左下图,萃取剂A、B中pH对钴、锰离子萃取率的影响如右下图:

①浸出温度控制在50-60℃的原因是_________________________。
②应选择萃取剂_________________________(填“A”或“B”)。
(5)“系列操作”依次是____________、______________和过滤等;制得的CoCl2·6H2O需减压烘干的原因是_________________________。
【答案】 1.0×10-15 Co2O3+SO32-+4H+==2Co2++SO42-+2H2O Cl2 ClO3-+6Fe2++6H+==Cl-+6Fe3++3H2O 50~60℃时钴浸出率高,温度再升高时钴浸出率变化不大,且导致浸出液中含铁元素的杂质含量升高 B 蒸发浓缩 冷却结晶 降低烘干温度,防止CoCl2·6H2O分解
【解析】(1). 25℃,在含有Co2+0.1 molL-1的溶液中,当溶液的pH=7时,Co2+开始沉淀,则Co(OH)2的Ksp=c(Co2+)×c2(OH-)=0.1×(10-7)2=1.0×10-15,故答案为:1.0×10-15;
(2). 在浸出工序中加入一定量的盐酸和Na2SO3还原Co2O3,硫元素化合价升高生成SO42-,钴元素化合价降低生成Co2+,根据得失电子守恒和原子守恒,Co2O3发生反应的离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,故答案为:Co2O3+SO32-+4H+==2Co2++SO42-+2H2O;
(3). 氧化工序中加入NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,该反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,若不慎加入过量NaClO3,在酸性条件下,NaClO3与溶液中的Cl-会发生氧化还原反应生成有毒的Cl2,故答案为:Cl2;ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(4). ① .据图可知,50~60℃时钴的浸出率已经很高,且温度再升高时钴的浸出率变化不大,同时还会导致铁的浸出率增大,含铁元素的杂质含量升高,故答案为:50~60℃时钴浸出率高,温度再升高时钴浸出率变化不大,且导致浸出液中含铁元素的杂质含量升高;
②. 加入萃取剂的目的是除去Mn2+,据图可知,选择萃取剂B时,Mn2+的萃取率高而Co2+的萃取率低,所以应选择萃取剂B,故答案为:B;
(5). 从溶液中得到氯化钴晶体的系列操作步骤为:蒸发浓缩、冷却结晶和过滤,制得的CoCl2·6H2O采用减压烘干方法,可以降低烘干温度,防止CoCl2·6H2O晶体分解,故答案为:蒸发浓缩;冷却结晶;降低烘干温度,防止CoCl26H2O分解。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示的图解表示构成细胞的元素、化合物及其作用,a.b.c.d代表不同的小分子物质,A.B.C代表不同的大分子,请分析回答下列问题:
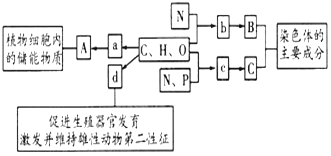
(1)物质a是_______,在动物细胞内,与物质A作用最相近的物质是_______。若物质A在动物、植物细胞均可含有,并作为细胞内的最理想的储存能量的物质,不仅能量多而且体积较小,则A是_________。
(2)物质d是________,化学本质是一种_________。同属于此类的还有胆固醇,其作用是构成__________的重要成分,在人体内还参与_______运输。
(3)物质b是________,若某种B分子含有2条链,由18个b分子(平均相对分子质量为128)组成的组成,则该B分子的相对分子质量大约为__________。
(4)物质c在人体细胞中共有_____种,分子中__________不同,决定了c的种类不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1的一元酸HA与0.1 mol·L-1的NaOH溶液等体积混合后,所得溶液pH>7,下列说法正确的是
A.混合前一元酸HA的c(H+)=0.1 mol·L-1
B.该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.HA在水溶液中的电离方程式:HA = H+ + A-
D.该混合溶液中:c(A-)+ c(HA)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(反应条件及副产物已略去)。
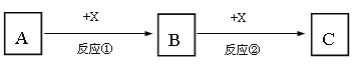
(1)若A、B、C均为含有同种非金属元素的化合物,A为使湿润的红色石蕊试纸变蓝的气体,B接触空气立刻变为C,则反应①的化学方程式为_______________________。
(2)若A、B、C为焰色反应均呈黄色的化合物,X为无色无味气体,则反应②的离子方程式为_____________________________________________。
(3)若A、B、C均为含有同种金属元素的化合物,X是强碱,则反应②的离子方程式为________________________________________________。
(4)若A为单质Fe,X为稀硝酸,若向B的溶液中加入氢氧化钠溶液,现象为________________________________________。
(5)若A和X均为单质,B为可使品红溶液褪色的气体,则反应②的化学方程式为_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2001年诺贝尔化学奖授予"手性碳原子的催化氢化,氧化反应"研究领域作出贡献的美,日三位科学家,手性分子具有镜像异构及光学活性,下列分子中具有光学活性的是
A.CBr2F2 B.CH3CH2OH
C.CH3CH2CH3 D.CH3CH(OH)COOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
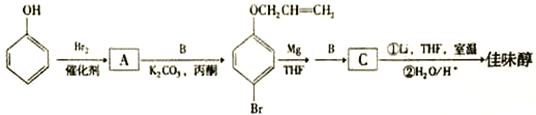
【题目】
佳味醇是一种重要的有机合成中间产物,也可直接作农药使用。下图是以苯酚为原料合成佳味醇的流程:
已知:
①![]() (THF为一种有机溶剂)
(THF为一种有机溶剂)
②![]()
回答下列问题:
(1)B的分子式为C3H5Br,B的结构简式为_________________。
(2)A 与B反应的反应类型为_____________________。
(3)由C→佳味醇的化学方程式为_________________________________。
(4) D是化合物B的一种同分异构体,其核磁共振氢谱显示有2种不同的化学环境的氢,且峰面积比为4∶1,D的结构简式为_____________________________。
(5)写出符台下列要求的佳味醇的所有同分异构体的结构简式___________________。
①遇FeCl3溶液呈紫色
②苯环上有两个取代基,且苯环上的一氯代物只有两种。
(6)化合物B经过下列转化,可合成用于制造树脂、合成橡胶乳液的有机原料丙烯酸。
![]()
i..完成从F到丙烯酸的合成路线___________________________________;
ii.设置反应②的目的是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某固体物质可能含有氯化钾、硫酸铜、氢氧化钠、硝酸镁,硫酸钠中的一种或几种,为鉴定它们,做如下实验:
①将该固体物质全部溶解于水中,得到无色溶液a。
②取少量a溶液于试管中,向其中滴加少量硫酸铁溶液,产生红褐色沉淀
③另取少量a溶液于试管中,向其中滴加少量的硝酸钡溶液,产生白色沉淀
步骤③中发生反应的化学方程式__________________________。据此推断,该固体物质中一定含有(以下写化学式,下同)______________,一定不含有________________,可能含有_____。
(2)下图是初中化学常见六种物质之间的关系图(物质是溶液的只考虑溶质)。图中用“—”表示两种物质之间能发生化学反应,用“→”表示一种物质可以转化为另一种物质(部分反应物或生成物及反应条件已略去)。
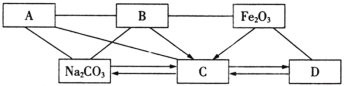
A是一种碱,其中阳离子是人体骨骼中的主要成分,B是胃酸的主要成分。C、D中所含元素种类相同。
①请分别写出A、B、C、D物质的化学式(或溶质的化学式):
A.___________ B.___________ C.___________ D.___________;
②写出Fe2O3反应生成C物质的化学方程式___________________________(写一个);
③写出Fe2O3与足量B反应的实验现象_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品,电化学合成碳酸二甲酯的工作原理如图所示(加入两极的物质均是常温常压下的物质)。下列说法正确的是
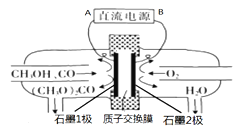
A. B为直流电源正极
B. H+由石墨2极通过质子交换膜向石墨l极移动
C. 石墨l极发生的电极反应为:2CH3OH + CO-2e= (CH3O)2CO + 2H+
D. 电解一段时间后,阴极和阳极消耗的气体的物质的量之比为l∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com