
��8�֣��ס���Ԫ�صĵ��ʺͻ�����Ӧ�ù㷺��
��1����Ԫ�ص�ԭ�ӽṹʾ��ͼ��____________��
��2��������뽹̿��ʯӢɰ��ϣ��ڵ�¯�м��ȵ�1500�����ɰ��ף���ӦΪ��2Ca3��PO4��2��6SiO2===6CaSiO3��P4O10 10C��P4O10===P4��10CO
ÿ����1 mol P4ʱ������________mol���ӷ���ת�ơ�
��3����������ƣ�Na2S2O3���dz��õĻ�ԭ������ά����C����ѧʽC6H8O6����ˮ��Һ�м������I2��Һ��ʹά����C��ȫ������ʣ���I2��Na2S2O3��Һ�ζ����ɲⶨ��Һ��ά����C�ĺ����������ķ�ӦΪ��
C6H8O6��I2===C6H6O6��2H����2I�� 2S2O32����I2===S4O62����2I��
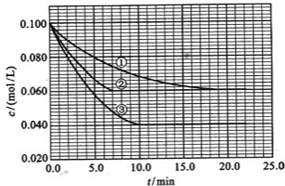
��һ�������ijά����C��Һ�м���a mol��L��1 I2��ҺV1 mL����ַ�Ӧ����Na2S2O3��Һ�ζ�ʣ���I2������b mol��L��1 Na2S2O3��ҺV2 mL������Һ��ά����C�����ʵ�����__________mol��
��4����������Һ�У�����أ�KIO3�����������ƿɷ������·�Ӧ��
2IO3����5SO32����2H��===I2��5SO42����H2O
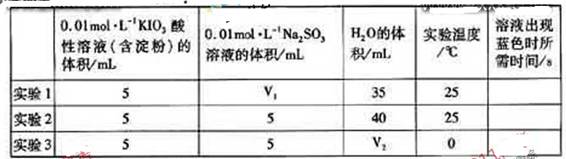
���ɵĵ�����õ�����Һ���飬���ݷ�Ӧ��Һ������ɫ�����ʱ���������÷�Ӧ�����ʡ�ijͬѧ���ʵ�����±���ʾ��
|
| 0.01mol��L��1KIO3������Һ�������ۣ������/mL | 0.01mol��L��1 Na2SO3��Һ�����/mL | H2O�����/mL | ʵ���¶� /�� | ��Һ������ɫʱ����ʱ��/s |
| ʵ��1 | 5 | V1 | 35 | 25 |
|
| ʵ��2 | 5 | 5 | 40 | 25 |
|
| ʵ��3 | 5 | 5 | V2 | 0 |
|
��ʵ���Ŀ����______________________________________________������V2=___________mL
II��ϡ��Ԫ���DZ����ս����Դ���ҹ����̲�����������λ��
��5���棨Ce���ǵؿ��к�����ߵ�ϡ��Ԫ�ء��ڼ���������CeCl3����ˮ�⣬��ˮCeCl3���ü���CeCl3��6H2O��NH4Cl��������ķ������Ʊ�������NH4Cl��������
 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����


| 2aV1-bV2 |
| 2000 |
| 2aV1-bV2 |
| 2000 |
| 0.01mol?L-1 KIO3������Һ�������ۣ������/mL |
0.01mol?L-1 Na2SO3��Һ�����/mL |
H2O����� /mL |
ʵ�� �¶� /�� |
��Һ������ɫʱ����ʱ��/s | |
| ʵ��1 | 5 | V1 | 35 | 25 | |
| ʵ��2 | 5 | 5 | 40 | 25 | |
| ʵ��3 | 5 | 5 | V2 | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


| aV1-0.5bV 2 |
| 1000 |
| aV1-0.5bV 2 |
| 1000 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2- 3 |
2- 6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
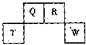 ��2012?������һģ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺
��2012?������һģ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺

| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ���������� ���ͣ������
I.�ס���Ԫ�صĵ��ʺͻ�����Ӧ�ù㷺��
��1����Ԫ�ص�ԭ�ӽṹʾ��ͼ�� ��
��2��������뽹̿��ʯӢɰ��ϣ��ڵ�¯�м��ȵ�1500��C���ɰ��ף���ӦΪ��
2Ca3��PO4��2+6SiO2==6CaSiO3+P4O10 10C+P4O10==P4+10CO
ÿ���� 1molP4 ʱ������ mol���ӷ���ת�ơ�
��3����������ƣ�Na2S2O2���dz��õĻ�ԭ������ά����C����ѧʽC6��8��6����ˮ��Һ�м������I2��Һ��ʹά���ء���ȫ������ʣ���I2����Na2S2O2��Һ�ζ����ɲⶨ��Һ��ά����C�ĺ����������ķ�ӦΪ��
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
��һ�������ijά����C��Һ�м���amolL-1I2��ҺV1ml,��ַ�Ӧ����Na2S2O2��Һ�ζ�ʣ���I2,����bmolL-1 Na2S2O2��ҺV2ml.����Һ��ά����C���������� mol��
��4����������Һ�У�������(KIO3)���������ƿɷ������·�ӳ��
2IO3-+5SO32-+2H+==I2+5SO42++H2O
���ɵĵ�����õ���Һ���飬���ݷ�Ӧ��Һ������ɫ�����ʱ���������÷�Ӧ�����ʡ�ijͬѧ���ʵ�����±���ʾ��
��ʵ���Ŀ����______������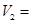 ______ML��
______ML��
II ϡ��Ԫ���DZ����ս����Դ���ҹ����̲�����������λ��
��5������Ce���ǵؿ��к�����ߵ�ϡ��Ԫ�أ��ڼ���������CeCl3����ˮ�⣬��ˮCeCl3�����ü���CeCl3• 6H2O��NH4Cl��������ķ������Ʊ������У�NH4Cl��������___________��
��6����ijǿ���Ի��ϡ����Һ�м���H2O2������pH ��3. Ce5+ͨ�����з�Ӧ�γ�Ce
��OH��4�������Է��롣��ɷ�Ӧ�����ӷ���ʽ��
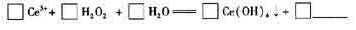
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com