
【题目】下列化学式中只能表示一种物质的是( )
A. C3H7OH B. CH2O C. C2H6O D. C3H6O2
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的是
A. 1s22s22p63s23p4 B. 1s22s22p3
C. 1s22s22p2 D. ls22s22p63s23p1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量(用n(H2)表示)对N2(g)+3H2(g) ![]() 2NH3(g) ΔH < 0反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g) ΔH < 0反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
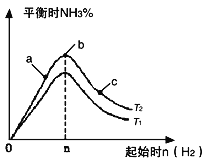
① 比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是_____________;
② 若容器容积为1L,n=3mol,反应达到平衡时H2的转化率为60%,H2与 N2物质的量之比为3∶1,则在起始时体系中加入N2的物质的量为___________mol,此条件下(T2),反应的平衡常数K = ______________;
③ 图像中T2和T1的关系是T2_____________ T1(填“高于”、“低于”、“等于”、“无法确定”)。
(2)N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2 N2O5 (g)4NO2(g)+O2(g)△H>0T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/molL-1 | 5.00 | 3.52 | 2.50 | 2.50 |
①达平衡后其他条件不变,将容器的体积压缩到原来的![]() ,则c(N2O5)_______(填“大于”、“小于”、“等于”、“无法确定”)5.00molL-1
,则c(N2O5)_______(填“大于”、“小于”、“等于”、“无法确定”)5.00molL-1
②500s内N2O5分解速率为 ____________;
③T1温度下 平衡时N2O5的转化率为____________;
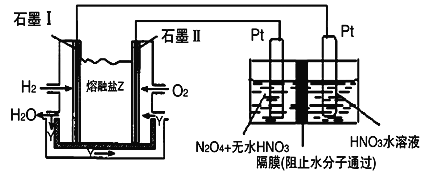
(3)现以H2、O2与熔融盐Na2CO3组成的燃料电池(如图所示,其中Y为CO2)装置进行电解。
写出石墨II电极上发生反应的电极反应式__________________ 。
在电解池中生成N2O5的电极反应式为__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,是一种常用的食品添加剂.该化合物具有如下性质:①在25℃时,A的电离平衡常数K1=3.9×10-4,K2=5.5×10-6②A+RCOOH(或ROH)![]() 有香味的产物③1molA
有香味的产物③1molA![]() 慢慢产生1.5mol气体④核磁共振氢谱表明A分子中有5种不同化学环境的氢原子,与A相关的反应框图如下:
慢慢产生1.5mol气体④核磁共振氢谱表明A分子中有5种不同化学环境的氢原子,与A相关的反应框图如下:
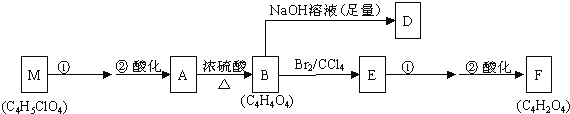
(1)根据化合物A的性质,对A的结构可作出的判断是______.
(a)肯定有碳碳双键(b)有两个羧基(c)肯定有羟基(d)有-COOR官能团
(2)写出A、D、F、M的结构简式:A:____________;D:______;F:______;M:______.
(3)写出A→B、B→E的反应类型:A→B____________;B→E_________________.
(4)写出M→A的第①步反应的反应条件:________________;写出E→F的第①步反应的反应方程式:______________________.
(5)在催化剂作用下,B与乙二醇可发生缩聚反应,生成的高分子化合物用于制造玻璃钢.写出该反应的化学方程式:____________________.
(6)写出一种与A具有相同官能团的A的同分异构体的结构简式______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是
A.1 mol O的质量为16 g B.1 mol氮的质量为 28 g/mol
C.1 mol C的质量为12 g/mol D.1 mol 氢的质量为1 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物沸点比较错误的是:( )
A. 丙烷>乙烷>甲烷 B. 正戊烷>异戊烷>新戊烷
C. 邻二甲苯>间二甲苯>对二甲苯 D. 对二甲苯>邻二甲苯>间二甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置,下列叙述不正确的是
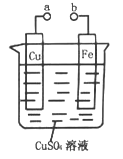
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为:Fe-2e-=Fe2+
C. a和b用导线连接时,电子从Cu片流向铁片
D. a和b用导线连接时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是_____________ (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________ (选填“酸性”“中性”或“碱性”),理由是__________________,溶液中各离子浓度大小的关系是_____________________。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为_____________________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应 ≥____________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com