
(14分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应可制备氧气。
①取等物质的量浓度等体积溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
| 序号 | 条件 | 现象 | 结论 | |
| 1 | 温度/℃ | 催化剂 | ||
| 2 | 40 | FeCl3溶液 |
|
|
| 3 | 20 | FeCl3溶液 |
|
|
| 4 | 20 | MnO2 |
|
|
| 5 | 20 | 无 |
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
②实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。
(2)Na2O2与水反应也可生成O2。某同学取4 g Na2O2样品与过量水反应,待反应完全终止时,得100 mL溶液X和448 mL O2(已折算为标准状况)。该同学推测样品中含有杂质或反应中生成H2O2,并进行实验研究。
①取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀。则反应的离子方程式是 。
②通过如上图所示整套实验装置测定Na2O2样品的纯度,假设所含杂质不参加反应。取25 mL X,滴入烧瓶内使其与过量KMnO4酸性溶液反应,最终生成56 mL O2(已折算为标准状况),则此样品中:Na2O2的质量分数是 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013届江苏省盐城市明达中学高三上学期学情调研考试化学试卷(带解析) 题型:填空题
(14 分)过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。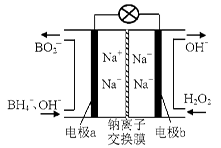
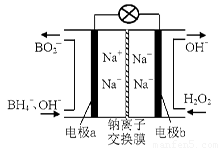
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为: ;
以MnO2做正极材料,可能是因为 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢
为助燃剂。已知:
N2H4(g) + O2(g) = N2(g) + 2H2O(g) △H =" –" 534 kJ·mol-1
H2O2(l) = H2O(l) + 1/2O2(g) △H =" –" 98.64 kJ·mol-1
H2O(l) = H2O(g) △H=" +" 44kJ·mol-1
则反应N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) 的△H= 。
(3)O3 可由臭氧发生器(原理如右图所示)电解稀硫酸制得。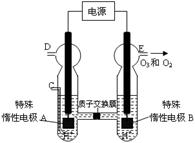
② 图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: 。
③若C处不通入O 2 ,D、E处分别收集到15.68L和有6.72L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为 (忽略 O 3 的分解)。
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx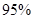 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)  NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是 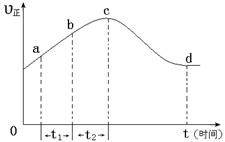
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省盐城市高三上学期学情调研考试化学试卷(解析版) 题型:填空题
(14 分)过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为: ;
以MnO2做正极材料,可能是因为 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢
为助燃剂。已知:
N2H4(g) + O2(g) = N2(g) + 2H2O(g) △H =" –" 534 kJ·mol-1
H2O2(l) = H2O(l) + 1/2O2(g) △H =" –" 98.64 kJ·mol-1
H2O(l) = H2O(g) △H=" +" 44kJ·mol-1
则反应N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) 的△H= 。
(3)O3 可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
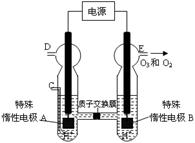
② 图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: 。
③若C处不通入O 2 ,D、E处分别收集到15.68L和有6.72L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为 (忽略 O 3 的分解)。
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx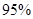 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)  NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
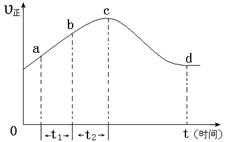
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源:北京市西城区2010年高三一模(理科综合)化学部分 题型:实验题
(14分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应 可制备氧气。
可制备氧气。
①取等物质的量浓度等体积 溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
|
序号 |
条件 |
现象 |
结论 |
|
|
1 |
温度/℃ |
催化剂 |
||
|
2 |
40 |
FeCl3溶液 |
|
|
|
3 |
20 |
FeCl3溶液 |
|
|
|
4 |
20 |
MnO2 |
|
|
|
5 |
20 |
无 |
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
②实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。

(2)Na2O2与水反应也可生成O2。某同学取4 g Na2O2样品与过量水反应,待反应完全终止时,得100 mL溶液X和448 mL O2(已折算为标准状况)。该同学推测样品中含有杂质或反应中生成H2O2,并进行实验研究。
①取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀。则反应的离子方程式是 。
②通过如上图所示整套实验装置测定Na2O2样品的纯度,假设所含杂质不参加反应。取25 mL X,滴入烧瓶内使其与过量KMnO4酸性溶液反应,最终生成56 mL O2(已折算为标准状况),则此样品中:Na2O2的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com