
| ||
| ||


科目:高中化学 来源: 题型:
| A、电解熔融氢氧化钠制钠,阴极发生电极反应为:Na++e-=Na |
| B、盖?吕萨克法制钠原理是利用铁的还原性比钠强 |
| C、若戴维法与盖?吕萨克法制得等量的钠,则两反应中转移的电子总数比为1:2 |
D、目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用丁达尔现象可以区别溶液和胶体 |
| B、胶体都可以发生丁达尔现象 |
| C、胶体粒子的大小都在1nm-100nm之间 |
| D、加热氢氧化铁胶体没有明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
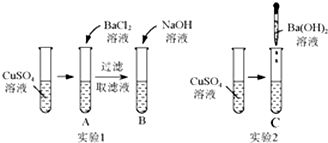 仔细分析如图中的实验:
仔细分析如图中的实验:| A | B | C |
| 产生白色沉定, 溶液仍为蓝色 | 产生蓝色沉定, 溶液变为无色 | 产生蓝色沉淀, 溶液为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸钠晶体 |
| B、豆浆 |
| C、Fe (OH)3胶体 |
| D、75%的酒精溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化钠溶液 |
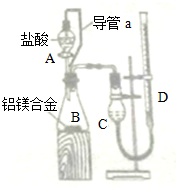
| 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com