
| 装置 | 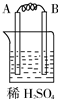 甲 甲 | 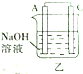 | 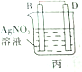 | 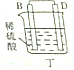 |
| 现象 | A不断溶解 | A极有气泡产生 | B电极质量增加 | B、D电极均无明显变化 |
分析 (1)电极A、B、C、D分别是Mg、Al、Cu、Ag中的一种,
甲中电解质溶液是稀硫酸,看到的现象是:A不断溶解,说明在金属活动性顺序表中A位于H之前,A的活泼性大于B;
乙中A极有气泡产生,能和氢氧化钠溶液反应生成气体的只有Al,所以A是Al;
丁中B、D电极均无明显变化,说明B、D都不和稀硫酸反应,则都位于H之后,应该是Cu、Ag两种金属,则C是Mg;
丙装置中B电极质量增加,说明B作正极,析出金属,则D活动性大于B,D为Cu、B为Ag;
(2)乙装置中Al是负极、Mg是正极,正极C上水得电子生成氢气;
(3)乙中A是Al、C是Mg,较活泼的金属Mg作正极、较不活泼金属Al作负极.
解答 解:(1)电极A、B、C、D分别是Mg、Al、Cu、Ag中的一种,
甲中电解质溶液是稀硫酸,看到的现象是:A不断溶解,说明在金属活动性顺序表中A位于H之前,A的活泼性大于B;
乙中A极有气泡产生,能和氢氧化钠溶液反应生成气体的只有Al,所以A是Al;
丁中B、D电极均无明显变化,说明B、D都不和稀硫酸反应,则都位于H之后,应该是Cu、Ag两种金属,则C是Mg;
丙装置中B电极质量增加,说明B作正极,析出金属,则D活动性大于B,D为Cu、B为Ag,
故答案为:Al;Cu;
(2)乙装置中Al是负极、Mg是正极,正极C上水得电子生成氢气,电极反应式为2H2O+2e-═H2↑+2OH-,故答案为:2H2O+2e-═H2↑+2OH-;
(3)乙中A是Al、C是Mg,较活泼的金属Mg作正极、较不活泼金属Al作负极,所以不能根据金属活泼性强弱判断正负极,所以不可靠,故答案为:不可靠.
点评 本题考查原电池正负极的判断、电极反应式的书写,为高频考点,注意:不能根据金属活泼性强弱判断正负极,要根据给予环境条件下失电子难易程度判断正负极,难点是电极反应式的书写,要结合电解质特点书写.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
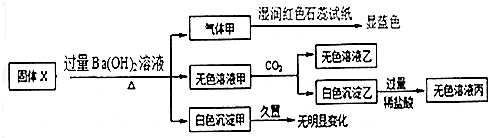
| A. | 气体甲一定是纯净物 | |
| B. | 白色沉淀乙不一定是Al(OH)3 | |
| C. | 固体X中一定存在 (NH4)2SO4、MgCl2、AlCl3 | |
| D. | 固体X中一定存在FeCl2、AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;Na2O2的电子式
;Na2O2的电子式 .
.| 非金属性 | 离子半径 | 热稳定性 | 酸性 |
| N<Cl | S2->Na+ | NH3<H2O | H2SO4 >HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | BaCl2+K2SO4═BaSO4↓+2KCl | B. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | ||
| C. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | D. | Ba(OH)2+2KHSO4═BaSO4↓+K2SO4+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com