
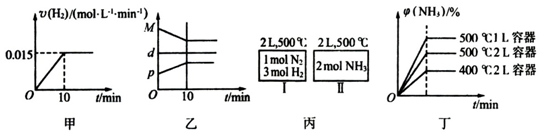
| A. | 若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 | |
| B. | 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 | |
| C. | 如图丙所示,容器I和II达到平衡时,NH3的体积分数为φ,则容器I放出热量与容器II吸收热量之和为92.4kJ | |
| D. | 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
分析 A、达到平衡时放出的热量为9.24kJ,由热化学方程式可知参加反应的氢气的物质的量为0.3mol,10min内氢气的平均速率为0.015mol/(L•min),反应速率应为由高到低;
B、混合气体的总质量不变,容器的体积不变,混合气体的密度为定值;随反应进行、混合气体的物质的量减小,混合气体的平均相对分子质量增大、混合气体的压强降低;
C、恒温恒容下,容器Ⅱ中按化学计量数转化为N2、H2,可得N21mol、H23mol,容器Ⅰ、容器Ⅱ内为等效平衡.平衡时容器内对应各物质物质的量相等,令平衡时容器内N2为nmol,结合热化学方程式计算;
D、增大压强平衡向正反应方向移动,升高温度平衡向逆反应方向移动.据此判断平衡时NH3的体积分数.
解答 解:A、反应开始速率相对较快,达平衡前反应速率相对较慢,所以反应速率应为由高到低,达到平衡时放出的热量为9.24kJ,由热化学方程式可知参加反应的氢气的物质的量为0.3mol,10min内氢气的平均速率为0.015mol/(L•min),最低反应速率应小于0.015mol/(L•min),故A错误;
B、混合气体的总质量不变,容器的体积不变,混合气体的密度为定值;随反应进行、混合气体的物质的量减小,混合气体的平均相对分子质量增大、混合气体的压强降低,故B错误;
C、恒温恒容下,容器Ⅱ中按化学计量数转化为N2、H2,可得N21mol、H23mol,容器Ⅰ、容器Ⅱ内为等效平衡.两种途径中达到平衡时,NH3的体积分数均为ω,平衡时容器内对应各物质物质的量相等,令平衡时容器内N2为nmol,则容器Ⅰ中放出的热量为(1-n)mol×92.4kJ/mol=92.4(1-n)kJ,容器Ⅱ内吸收的热量为nmol×92.4kJ/mol=92.4nkJ,容Ⅰ中放出的热量与Ⅱ中吸收的热量之和为92.4(1-n)kJ+92.4nkJ=92.4kJ,故C正确;
D、起始加入的物料均为1molN2、3molH2,在不同条件下达到平衡时,比较500℃、2L与500℃、1L,体积小压强大,反应速率快,达到平衡时间短,平衡向正反应移动,平衡时NH3的体积分数相对较大;比较500℃、2L与400℃、2L,温度增大,反应速率快,达到平衡时间短,平衡向逆反应移动,平衡时NH3的体积分数相对较小,故D错误.
故选C.
点评 本题考查平衡移动图象、等效平衡、外界对平衡及反应速率的影响等,难度中等,注意D选项中定一议二与先拐先平原则的利用.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:选择题
| A. | 在无色的溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在pH=11的溶液中:CO32-、Na+、NO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol•L?1的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 在酸性溶液中:Na+、NH4+、SO42-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和溶液的密度$\frac{(a+b)}{V}$ | |
| B. | 饱和溶液的物质的量浓度$\frac{100a(M-18x)}{MV}$ | |
| C. | 25℃,R的溶解度$\frac{100a(M-18x)}{(bM+18ax)}$ | |
| D. | 饱和溶液的质量分数$\frac{a(M-18x)}{(a+b)M}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、AlO2-、NO3- | B. | K+、Na+、HSO3-、Cl- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Fe3+、Na+、ClO-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙溶液跟盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 盐酸跟氢氧化镁溶液反应:H++OH-═H2O | |
| D. | 氢氧化钡跟硫酸铜反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
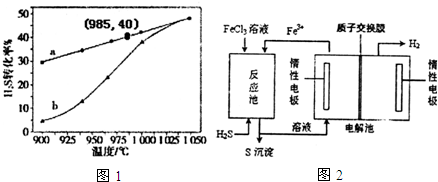
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com