

 ,故答案为:Fe2O3;
,故答案为:Fe2O3; ;
;
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、Ksp越小,则该物质在水中的溶解度肯定越小 |
| B、Ksp小的物质不可能转化为Ksp大的物质 |
| C、Ksp的大小只取决于物质属性,而与温度等其它因素无关 |
| D、易溶于水的物质也可能存在沉淀溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝与稀盐酸反应:Al2O3+6H+=2Al3++3H2O |
| B、氯化铵溶液与氢氧化钠溶液共热:NH4++OH-═NH3?H2O |
| C、碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- |
| D、硫酸亚铁溶液中加双氧水:Fe2++2H2O2+4 H+=Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
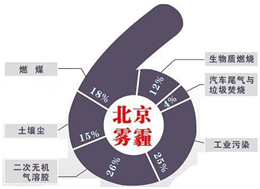 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.
| ||
| ||
| 催化剂 |
| ClO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
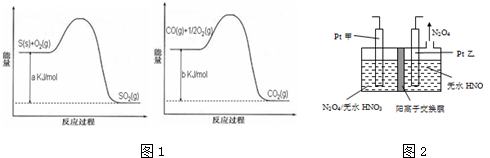
 依据叙述,写出下列反应的热化学方程式.
依据叙述,写出下列反应的热化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:
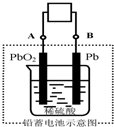 电瓶车所用的电池一般是铅蓄电池,该电池电压稳定,安全可靠,价格低廉,在生产、生活中广泛使用.其电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,该电池电压稳定,安全可靠,价格低廉,在生产、生活中广泛使用.其电池总反应式为:| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| A、②⑤ | B、③⑤ |
| C、②③④ | D、①④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com