

���� ��ͭ����ͭ�����ᡢ���ᷴӦ����ʽΪ3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O����ͭ������Ҳ�������Ʒ�Ӧ������pHĿ����ʹ������������������������������CΪ������������Һ�к�����ͭ��ͨ������Ũ������ȴ�ᾧ��������ͭ���壮
��1���ɹ�������ͼת����ϵ��֪����������Ĵ��ڣ������������ȫ�����������ã���Ϊϡ��Һ����������ͭ��NO��ˮ��
��2��������ҺPH��Ŀ���dz��������ӳ�ȥ��������Լ����������µ����ʣ�
��3��������ҺPH���������ӣ��ɹ�������ͼת����ϵ��֪����������Ҫ�ɷ�Ϊ����������
��4����������ʯ�Һ�ˮ��һ����������Ƴɲ�����Һ����������ͭ������ƣ�
��5������a���Ա�ѭ�����ã��䱻ѭ�����õ�ԭ��Ϊһ��������������Ӧ���ɶ�������������������ˮ��Ӧ���������һ��������
��6������ͭ���ȷֽ�����CuO��SO2���塢SO3�����O2���壬��Ӧ��ΪCuSO4��������ΪCuO��SO2��SO3��O2����ƽ����ʽ���ɣ�ͼ2��ʾ��ʵ��װ�÷ֱ�ⶨ���ɵ�SO2���塢SO3�����������O2����������SO3������ܽ���Ũ�����У�����98.3%��Ũ��������SO3���壬SO2�����ü�Һ���գ���������ˮ���������ݴ˷�����
��� �⣺��1����������Ĵ��ڣ��������������ȫ�����������ã���Ϊϡ��Һ����������ͭ��NO��ˮ����Ӧ����ʽΪ3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O��
�ʴ�Ϊ��3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O��
��2�������Լ�b�ǵ�����ҺPH���Ҳ��������µ����ʣ�ӦΪ����ͭ��������ͭ���ʽ̼��ͭ��̼��ͭ������������ͭ��Ӧ�����ӷ���ʽΪ��CuO+2H+=Cu2++H2O��
�ʴ�Ϊ������ͭ��������ͭ���ʽ̼��ͭ��̼��ͭ��CuO+2H+=Cu2++H2O��
��3���ɹ�������ͼת����ϵ��֪������Һ�н�����pHֵ��������ת��ΪFe��OH��3���������������Լ�������Һ��PH��ȥ����Һ�е�Fe3+������c����Ҫ�ɷ�ΪFe��OH��3��
�ʴ�Ϊ����ȥ����Һ�е�Fe3+��Fe��OH��3��
��4����������ʯ�Һ�ˮ��һ����������Ƴɲ�����Һ����������ͭ������ƣ���Ӧ�Ļ�ѧ����ʽΪ��CuSO4+H2O+CaO=Cu��OH��2��+CaSO4����
�ʴ�Ϊ��CuSO4+H2O+CaO=Cu��OH��2��+CaSO4����
��5������a���Ա�ѭ�����ã��û�ѧ����ʽ��ʾ�䱻ѭ�����õ�ԭ��Ϊ��һ��������������Ӧ���ɶ�������������������ˮ��Ӧ���������һ����������Ӧ�Ļ�ѧ����ʽ2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��4NO+3O2+2H2O=4HNO3��
�ʴ�Ϊ��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��4NO+3O2+2H2O=4HNO3��
��6������ͭ���ȷֽ�����CuO��SO2���塢SO3�����O2���壬��Ӧ��ΪCuSO4��������ΪCuO��SO2��SO3��O2����ƽ����ʽ�ã�3CuSO4$\frac{\underline{\;\;��\;\;}}{\;}$3CuO+SO3��+2SO2��+O2����
�ʴ�Ϊ��3CuSO4$\frac{\underline{\;\;��\;\;}}{\;}$3CuO+SO3��+2SO2��+O2����
���� ���⿼��ѧ���Թ������̵����⡢�Ķ���Ŀ��ȡ��Ϣ���������ʷ����ᴿ�Ȼ����������Ѷ��еȣ�Ҫ��ѧ��Ҫ����ʵ��ʵ�����֪ʶ�����Ӧ����Ϣ������֪ʶ��������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
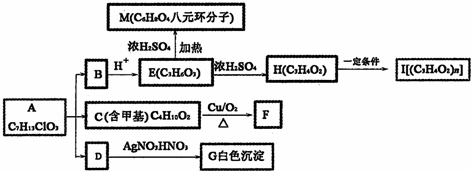
 +O2$��_{��}^{Cu}$
+O2$��_{��}^{Cu}$ +2H2O����E��M��2HOCH2CH2COOH$��_{��}^{ŨH_{2}SO_{4}}$
+2H2O����E��M��2HOCH2CH2COOH$��_{��}^{ŨH_{2}SO_{4}}$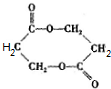 +2H2O��
+2H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪��HI��g���T$\frac{1}{2}$H2��g��+$\frac{1}{2}$I2��s����H=-26.5kJ/mol���ɴ˿�֪1mol HI�������ܱ������г�ַֽ����Էų�26.5kJ������ | |
| B�� | ��֪��2H2��g��+O2��g��=2H2O��l����H=-571.6kJ/mol����������ȼ����Ϊ��H=-285.8kJ/mol | |
| C�� | �£�N2H4����һ�����ڻ����ȼ�ϵ�ص�ԭ�ϣ���֪2H2O��g��+O2��g��=2H2O2��l����H=+108.3kJ/mol ��N2H4��l��+O2��g��=N2��g��+2H2O��g����H=-534.0kJ/mol �����з�Ӧ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��l����H=-642.3kJ/mol | |
| D�� | ��20.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ����������ϡ�����ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪ��NaOH��aq��+CH3COOH��aq��=CH3COONa��aq��+H2O��l����H=-57.4kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Һ�ʼ��Ե�ԭ���ǣ�CO32-+2H2O?H2CO3+2OH- | |
| B�� | ���MgCl2ˮ��Һ�����ӷ���ʽ��2Cl-+2 H2O $\frac{\underline{\;ͨ��\;}}{\;}$H2��+Cl2��+2OH- | |
| C�� | ������֮����������֮��������ˮ���ӷ��ſ����ǣ�D216O | |
| D�� | ����ƾ��Dz����ϳ��õ�ȼ�ϣ���֪�ƾ��ı�ȼ������-1366.8kJ•mol-1�����ʾ�ƾ���ȼ���ȵ��Ȼ�ѧ��ʽʽΪ�� C2H5OH��s��+3O2��g��=2CO2��g��+2 H2O��l����H=-1366.8kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
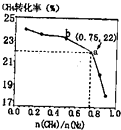 CH4����N2��һ����������ֱ�����ɰ���3CH4��g��+2N2��g��$?_{����}^{700��}$3C��s��+4NH3��g����H��0��700��ʱ��$\frac{n��C{H}_{4}��}{n��{N}_{2}��}$��CH4��ƽ��ת���ʵĹ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ�������
CH4����N2��һ����������ֱ�����ɰ���3CH4��g��+2N2��g��$?_{����}^{700��}$3C��s��+4NH3��g����H��0��700��ʱ��$\frac{n��C{H}_{4}��}{n��{N}_{2}��}$��CH4��ƽ��ת���ʵĹ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ�������| A�� | $\frac{n��C{H}_{4}��}{n��{N}_{2}��}$Խ��CH4��ת����Խ�� | |
| B�� | $\frac{n��C{H}_{4}��}{n��{N}_{2}��}$�벻��ʱ�����£�NH3������������С | |
| C�� | b���Ӧ��ƽ�ⳣ����a��Ĵ� | |
| D�� | a���Ӧ��NH3���������ԼΪ13% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ����̼���ƺ�̼������ | B�� |  �Ƶ�ȼ�� | ||
| C�� |  ��ȡ100.00mL��Һ | D�� |  ʵ������ȡ����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯ���ǻ���������Ʒ����Ҳ�ǻ���� | |
| B�� | NH4I�ĵ���ʽ��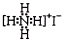 | |
| C�� | ���ࡢ�����ʺ����ᶼ����������Ӫ������ | |
| D�� | �մɡ�ˮ����ˮ�ࡢ���������ڹ����� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com