
| A. | 钠与冷水的反应 | |
| B. | 甲烷在氧气中的燃烧反应 | |
| C. | 灼热的木炭与CO2反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 3:1 | C. | 1:4 | D. | 5:13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油中通过常压分馏、减压分馏得到的汽油比催化重整后的汽油品质高 | |
| B. | 天然气和沼气的主要成分都是甲烷,燃烧天然气较环保 | |
| C. | 重油通过裂化可获得大量的轻质油 | |
| D. | 轻质油的裂解也可称为深度裂化,目的是为了获得大量的气态不饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液:①0.1mol/L HA溶液;②0.1mol/L HB溶液,分别与0.1mol/L NaOH溶液等体积混合后溶液中,c(H+):①<② | |
| B. | 等物质的量浓度的HA溶液与NaB溶液等体积的混合液:2c(Na+)═(A-)+c(B-)+c(HA)+c(HB) | |
| C. | pH=9的三种溶液①NaB;②NH3•H2O;③NaOH,由水电离出的c(OH-):①>②>③ | |
| D. | 物质的量浓度相等的NaA与NaB两溶液中:c(B-)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都约含有6.02×1023个原子 | |
| B. | 物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4NA | |
| C. | O2的摩尔质量是32 | |
| D. | 摩尔是物质的量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-═AlO2-+2H2O | |
| B. | 向Ca(ClO)2溶液中通入过量的SO2:C1O-+SO2+H2O═HClO+HSO3- | |
| C. | 氯气与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
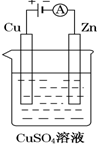 (1)合成氨反应的热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.2kJ•mol-1
(1)合成氨反应的热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.2kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com