
°æƒø°ø”–ª˙ŒÔ1£¨£¨3£¨5£¨7-–¡Àƒœ©ø…”√”⁄÷∆∫œ≥…œÀŒ¨°¢»æ¡œ°¢“©ŒÔµ»£¨∆‰Ω·ππ ºÚ ΩŒ™![]() °£∏√ŒÔ÷ µƒ∫œ≥…∑Ω∑®»Áœ¬ÕºÀ˘ æ£∫
°£∏√ŒÔ÷ µƒ∫œ≥…∑Ω∑®»Áœ¬ÕºÀ˘ æ£∫
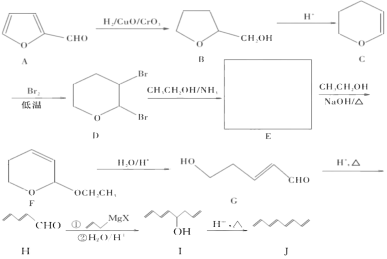
£®1£©1£¨3£¨5£¨7-–¡Àƒœ©µƒ∑÷◊” ΩŒ™______£¨”–ª˙ŒÔAÀ˘∫¨∫¨—ıπŸƒÐÕ≈”– _______£®ÃÓ√˚≥∆£©°£
£®2£©EµƒΩ·ππºÚ ΩŒ™______.
£®3£©I°˙Jµƒ∑¥”¶¿ý–ÕŒ™______.
£®4£©![]() ‘⁄“ª∂®Ãıº˛œ¬ø…“‘∑¢…˙º”æ€∑¥”¶£¨∫œ≥…ŒÞ÷ß¡¥µƒ¡¥◊¥”–ª˙∏þ∑÷◊”°£–¥≥ˆ∏√∑¥”¶µƒªØ—ß∑Ω≥à Ω: ________________________ .
‘⁄“ª∂®Ãıº˛œ¬ø…“‘∑¢…˙º”æ€∑¥”¶£¨∫œ≥…ŒÞ÷ß¡¥µƒ¡¥◊¥”–ª˙∏þ∑÷◊”°£–¥≥ˆ∏√∑¥”¶µƒªØ—ß∑Ω≥à Ω: ________________________ .
£®5£©∑˚∫œÃıº˛µƒGµƒÕ¨∑÷“ÏππÔ–___________÷÷°£
¢Ÿ”ÎúÀ·«‚ƒ∆»Ð“∫∑¥”¶≤˙…˙∆¯Ã ¢⁄≤ªƒÐ π‰ÂÀÆÕ …´
£®6£©“‘CH3CHO °¢ HCHO∫Õ![]() Œ™‘≠¡œ“≤ø…“‘∫œ≥…1£¨3£¨5£¨7-–¡Àƒœ©£¨ ‘–¥≥ˆ∫œ≥…¬∑œþ°££®∆‰À˚ ‘º¡»Œ—°£©_____________________________________________________________________ .“—÷™£∫
Œ™‘≠¡œ“≤ø…“‘∫œ≥…1£¨3£¨5£¨7-–¡Àƒœ©£¨ ‘–¥≥ˆ∫œ≥…¬∑œþ°££®∆‰À˚ ‘º¡»Œ—°£©_____________________________________________________________________ .“—÷™£∫![]() °£
°£
°æ¥∞∏°øC8H10 »©ª˘°¢ÃºÃºÀ´º¸°¢√—º¸ 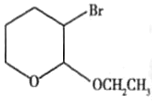 º”≥…∑¥”¶
º”≥…∑¥”¶ ![]() 4 CH3CHO+HCHO
4 CH3CHO+HCHO![]()
![]()
![]()
![]()
°æΩ‚Œˆ°ø
£®1£©∏˘æðΩ·ππºÚ Ω£¨∂•µ„∫ÕΩ⁄µ„Œ™Ãº£¨∆‰”ý≤ª¬˙Àƒº¸µƒŒª÷√»´≤ø≤π≥‰«‚‘≠◊”£¨1£¨3£¨5£¨7-–¡Àƒœ©µƒ∑÷◊” ΩŒ™C8H10£ª∏˘æð”–ª˙ŒÔAµƒΩ·ππºÚ Ω£¨À˘∫¨∫¨—ıπŸƒÐÕ≈”–»©ª˘°¢ÃºÃºÀ´º¸°¢√—º¸£ª
¥∞∏Œ™£∫C8H10£ª»©ª˘°¢ÃºÃºÀ´º¸°¢√—º¸£ª
£®2£©¥”Âպ÷–µƒ∏˜ŒÔ÷ ÷ƺ‰µƒ◊™ªØπÿœµø…÷™£¨D°˙E «““¥º÷–µƒ-OCH2CH3»°¥˙D÷–”ÎOœý¡⁄µƒÃº…œµƒ‰Â‘≠◊”£¨E°˙F∑¢…˙µƒ «œ˚»•∑¥”¶£¨E÷–Õ—»•1∏ˆHBr ∑÷◊”£¨µ√µΩF£¨À˘“‘EµƒΩ·ππºÚ ΩŒ™ £ª
£ª
¥∞∏Œ™£∫
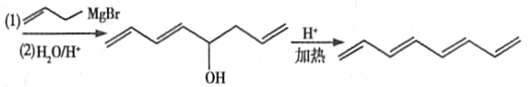
£®3£©¥”I°˙Jµƒ∑¥”¶∑¥”¶π˝≥Ã÷–£¨I÷–µƒ“ª∏ˆÀ´º¸±‰Œ™µ•º¸≤¢¡¨Ω”¡À“ª∏ˆÙ«ª˘∫Õ“ª∏ˆ«‚‘≠◊”◊™±‰Œ™J£¨∑¢…˙µƒ∑¥”¶¿ý–ÕŒ™º”≥…∑¥”¶°£
¥∞∏Œ™£∫º”≥…∑¥”¶£ª
£®4£©![]() ‘⁄“ª∂®Ãıº˛œ¬ø…“‘∑¢…˙º”æ€∑¥”¶£¨∫œ≥…ŒÞ÷ß¡¥µƒ¡¥◊¥”–ª˙∏þ∑÷◊”°£‘≠¿¥µƒÀ´º¸¥Úø™œýª•¡¨Ω”£¨∆‰À˚µƒº¸÷ÿ–¬◊È∫œŒ™À´º¸£¨ªØ—ß∑Ω≥Ã ΩŒ™
‘⁄“ª∂®Ãıº˛œ¬ø…“‘∑¢…˙º”æ€∑¥”¶£¨∫œ≥…ŒÞ÷ß¡¥µƒ¡¥◊¥”–ª˙∏þ∑÷◊”°£‘≠¿¥µƒÀ´º¸¥Úø™œýª•¡¨Ω”£¨∆‰À˚µƒº¸÷ÿ–¬◊È∫œŒ™À´º¸£¨ªØ—ß∑Ω≥Ã ΩŒ™![]() £ª
£ª
¥∞∏Œ™£∫![]()
£®5£©Gµƒ∑÷◊” ΩŒ™C5 H8 O2£¨GµƒÕ¨∑÷“ÏππÔÎúÀ·«‚ƒ∆∑¥”¶ø…“‘≤˙…˙∆¯Ã£¨‘Ú∆‰Ω·ππ÷–∫¨”–-COOH£¨«“∆‰≤ªƒÐ π‰ÂÀÆÕ …´£¨‘Ú¬˙◊„Ãıº˛µƒÕ¨∑÷“ÏππÔ– °¢
°¢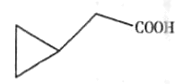 °¢
°¢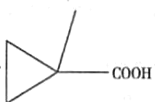 °¢
°¢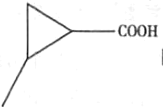 π≤Àƒ÷÷
π≤Àƒ÷÷
¥∞∏Œ™£∫4£ª
£®6£©CH3CHO+HCHO![]()
![]()
![]()
![]()

¥∞∏Œ™£∫CH3CHO+HCHO![]()
![]()
![]()
![]()




| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–Àµ∑®’˝»∑µƒ «£® £©
A. «øµÁΩ‚÷ »Ð“∫µƒµºµÁƒÐ¡¶“ª∂®±»»ıµÁΩ‚÷ »Ð“∫µƒ«ø
B. “ª∂®Œ¬∂»œ¬£¨ø…ƒÊ∑¥”¶2X(g)£´Y(g)![]() 2Z(g)¥ÔµΩ∆Ω∫‚µƒ±Í÷æ «£∫»ð∆˜ƒ⁄X°¢Y°¢ZµƒŒÔ÷ µƒ¡ø÷Ʊ»Œ™2£∫1£∫2
2Z(g)¥ÔµΩ∆Ω∫‚µƒ±Í÷æ «£∫»ð∆˜ƒ⁄X°¢Y°¢ZµƒŒÔ÷ µƒ¡ø÷Ʊ»Œ™2£∫1£∫2
C. …˝∏þŒ¬∂»£¨AgClµƒ»ÐΩ‚∂»‘ˆ¥Û£¨Ksp‘ˆ¥Û
D. FeCl3°¢KAl(SO4)2°¢Na2CO3µƒÀƻГ∫æ˘œ‘À·–‘
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øµ‚‘⁄µÿø«÷–÷˜“™“‘NaIO3µƒ–Œ Ω¥Ê‘⁄£¨‘⁄∫£ÀÆ÷–÷˜“™“‘I-µƒ–Œ Ω¥Ê‘⁄£¨º∏÷÷¡£◊”÷ƺ‰”–»ÁÕºÀ˘ 浃◊™ªØπÿœµ°£∏˘æðÕº æ◊™ªØπÿœµÕ∆≤‚œ¬¡–Àµ∑®’˝»∑µƒ «
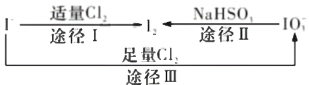
A.ø…”√µÌ∑€-KI ‘÷Ω∫Õ ≥¥◊ºÏ—Ⱥ”µ‚—Œ÷– «∑Ò∫¨”–µ‚‘™Àÿ
B.œÚµÌ∑€-KI»Ð“∫÷–Õ®»Îπ˝¡øCl2£¨◊Ó÷’»Ð“∫≥ ¿∂…´
C.”…Õºø…÷™—ıªØ–‘µƒ«ø»ıÀ≥–ÚŒ™C12 >I2 >IO3-
D.Õææ∂1∫ÕII÷–∏˜◊‘…˙≥…1 mol I2£¨∑¥”¶÷–◊™“∆µƒµÁ◊” ˝œýµ»
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø»˝¬»—ı¡◊£®(POCl3£©ø…”√”⁄÷∆±∏‘ˆÀк¡£¨≥£Œ¬œ¬Œ™ŒÞ…´Õ∏√˜“∫㨓◊ª”∑¢£¨“◊ÀÆΩ‚°£“ª÷–ªØ—ß–À»§–°◊ÈÃΩæø÷∆±∏POCl3À˘–˵ƒ◊∞÷√»Áœ¬ÕºÀ˘ æ£∫

∑¥”¶‘≠¿Ì£∫PCl3+Cl2+H2O![]() POCl3+2HCl£®PC13≥£Œ¬œ¬Œ™“∫裨“◊ª”∑¢£©°£
POCl3+2HCl£®PC13≥£Œ¬œ¬Œ™“∫裨“◊ª”∑¢£©°£
£®1£©“«∆˜3µƒ√˚≥∆ « _________£¨“«∆˜2÷–◊∞»ÎµƒŒÔ÷ Œ™______£¨“«∆˜Iµƒ◊˜”√ «_____.
£®2£©«Î—°‘Ò…œ ˆ±ÿ“™◊∞÷√≤¢◊È◊∞£¨”√–°–¥◊÷ƒ∏¡¨Ω”:________________________°£
£®3£©ø™ ºÕ®»Î¬»∆¯°£Õ¨ ±¬˝¬˝µŒº”ÀÆ£¨øÿ÷∆¬»∆¯∫ÕÀƵƒ÷ ¡ø±»‘⁄3.94◊Û”“£¨¿Ì”… «:________________________.
£®4£©…œ ˆ◊∞÷√”–“ª¥¶≤ª◊„£¨«Î÷∏åÁ∏√≤ª◊„:__________________________.
£®5£©…œ ˆ∑¥”¶ £”ýPCl3ø…“‘ºÃ–¯Õ®»ÎCl2£¨‘Ÿ∫ÕP4O10∑¥”¶£¨“≤ø…“‘≤˙…˙µƒPOC13 .°£ –¥≥ˆ∏√∑¥”¶µƒªØ—ß∑Ω≥à Ω:__________________________________ .
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¡∂Ã˙≥ßµƒ∑œ‘¸Ã˙∑Ø‘¸÷˜“™∫¨”–K2Fe6(SO4)4(OH)12 °¢ZnO![]() Fe2O3 º∞…Ÿ¡øµƒCaO°¢MgO°¢SiO2 £¨µ»µ»°£ø…¿˚”√∑œ‘¸Ã˙∑Ø‘¸÷∆±∏∏¥∫œƒ¯–øÃ˙—ı࣮NiZnFe4O8.æþÃÂ÷∆±∏¡˜≥ûÁœ¬ÕºÀ˘ æ£∫
Fe2O3 º∞…Ÿ¡øµƒCaO°¢MgO°¢SiO2 £¨µ»µ»°£ø…¿˚”√∑œ‘¸Ã˙∑Ø‘¸÷∆±∏∏¥∫œƒ¯–øÃ˙—ı࣮NiZnFe4O8.æþÃÂ÷∆±∏¡˜≥ûÁœ¬ÕºÀ˘ æ£∫

£®1£© ‘º¡1 «π˝¡øµƒ______°£
£®2£© ‘º¡2Œ™π˝¡øµƒÃ˙∑€£¨º”»Î∫Ûø…“‘π€≤ϵƒœ÷œÛ”– ______________________°£
£®3£©NH4F»Ð“∫≤ªƒÐ∑≈»Î≤£¡ß∆˜√Û÷–±£¥Ê£¨¿Ì”… «_____________________________£®”√¿Î◊”∑Ω≥Ã Ω±Ì æ£©°£“—÷™:25 °„C ±£¨Ksp(CaF2)=2.7°¡10£≠11°¢£¨Ksp(MgF2)=6.4°¡10£≠19°£º”»ÎNH4F»Ð“∫≥¡µÌ∫Û£¨c(Mg2+) = 1. 6°¡10-10mol L-1£¨¥À ±Ca2+ «∑Ò“≤ÕÍ»´≥¡µÌ£ø–¥≥ˆæþõƒ∑÷Œˆπ˝≥ã∫______£®»Ù»Ð“∫÷–ƒ≥¿Î◊”≈®∂»–°”⁄1.0°¡10£≠5mol L-1 ±£¨Àµ√˜∏√¿Î◊”“—≥¡µÌÕÍ»´£©°£
£®4£©‘⁄Fe2+°¢Ni2+°¢Zn2+π≤≥¡µÌπ˝≥Ã÷–£¨»Ù“‘Me¥˙±ÌFe°¢Ni°¢Zn‘™Àÿ£¨‘Ú…˙≥…MeCO32Me(OH)2H2O≥¡µÌµƒªØ—ß∑Ω≥Ã ΩŒ™ ________________________________.
£®5£©∞¥’’…œ ˆ¡˜≥㨓ª◊˘10ÕÚ∂÷πʃ£µƒ¡∂Ã˙≥ß√øƒÍ≤˙…˙Ã˙Ì∂‘¸‘º5ÕÚ∂÷£¨Fe3+∫¨¡øŒ™44.8%£¨¿Ì¬€…œ√øƒÍ÷¡…Ÿø…÷∆±∏∏¥∫œƒ¯–øÃ˙—ıã®NiZnFe4O8 £¨M=476 g mol -1 £©__________ÕÚ∂÷°£
£®6£©¬À“∫¢Ú÷–º”»ÎµƒZnSO4»Ð“∫£¨µÕŒ¬∫Ê∏…∫Ûø…µ√µΩ©∑Ø£®ZnSO4 7H2O) »°28.70 g©∑غ”»»÷¡≤ªÕ¨Œ¬∂»£¨ £”ýπÃõƒ÷ ¡ø±‰ªØ»ÁÕºÀ˘ æ£∫

¢Ÿ100 °„C ±À˘µ√πÃõƒªØ—ß Ω__________ °£
¢⁄680 °„C ±À˘µ√πÃ–ðµƒªØ—ß ΩŒ™____
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø “Œ¬œ¬£¨œÚ10 mL 0.1 mol/L¥◊À·»Ð“∫÷–º”ÀÆœ° Õ∫Û£¨œ¬¡–Àµ∑®’˝»∑µƒ «(°°°°)
A. »Ð“∫÷–¿Î◊”µƒ ˝ƒøºı–°
B. ‘Ÿº”»ÎCH3COONaπÃÃƒХŸΩ¯¥◊À·µƒµÁ¿Î
C. ¥◊À·µƒµÁ¿Î≥Ã∂»‘ˆ¥Û£¨c(H£´)“ý‘ˆ¥Û
D. »Ð“∫÷–c(CH3COO-)/c(CH3COOH)c(OH-)≤ª±‰
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“—÷™:¢Ÿ X°¢Y°¢Z°¢W°¢R°¢QŒ™‘≠◊”–Ú ˝“¿¥Œ‘ˆ¥Ûµƒ∂Ã÷Ð∆⁄‘™Àÿ°£X «À˘”–‘™Àÿ÷–‘≠◊”∞Îæ∂◊Ó–°µƒ‘™Àÿ£¨Y «–Œ≥…ªØ∫œŒÔ÷÷¿ý◊Ó∂ýµƒ‘™Àÿ£¨Wµƒ◊ÓÕ‚≤„µÁ◊” ˝ «¥ŒÕ‚≤„µÁ◊” ˝µƒ3±∂£¨Q”ÎWÕ¨÷˜◊£¨Y°¢R‘≠◊”µƒ◊ÓÕ‚≤„µÁ◊” ˝÷Æ∫Õµ»”⁄Zµƒ◊ÓÕ‚≤„µÁ◊” ˝°£
¢⁄¿≥ƒ…Àπ°§ø®∂˚°§±´¡÷‘⁄1932ƒÍ÷≥ˆelectronegativity◊˜Œ™‘™Àÿ‘≠◊”‘⁄ªØ∫œŒÔƒ≥÷÷–‘÷ µƒ±Í∂»£¨electronegativityµƒ¥Û–°ø…“‘≈–∂œ‘™ÀÿΩ Ù–‘”Î∑«Ω Ù–‘«ø»ı£¨œ¬±Ì¡–≥ˆ≤ø∑÷∂Ã÷Ð∆⁄‘™ÀÿµƒElectronegativityµƒ÷µ°£
‘™Àÿ | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
‘™Àÿ | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
«Îªÿ¥œ¬¡–Œ £®…ʺ∞X°¢Y°¢Z°¢W°¢R°¢Q ±£¨”√‘™Àÿ∑˚∫≈±Ì 棩£∫
(1)∏˘æð…œ±Ì∏¯≥ˆµƒ ˝æð£¨ø…÷™‘™Àÿµƒelectronegativity‘Ω¥Û£¨__(ÃÓ°∞Ω Ù–‘°±ªÚ°∞∑«Ω Ù–‘°±)‘Ω«ø°£
(2)‘™ÀÿQ‘⁄÷Ð∆⁄±Ì÷–µƒŒª÷√Œ™_________°£
(3)W°¢R°¢Qµ•∫ÀºÚµ•¿Î◊”∞Îæ∂”…¥ÛµΩ–°≈≈¡–À≥–ÚŒ™______°£
(4)‘™ÀÿX°¢Z°¢W÷ƺ‰ƒÐ–Œ≥…∂ý÷÷10µÁ◊”Œ¢¡££¨«Î–¥≥ˆ∑¥”¶ŒÔ∫Õ≤˙ŒÔæ˘Œ™X°¢Z°¢W÷ƺ‰–Œ≥…µƒ10µÁ◊”Œ¢¡£µƒ“ª∏ˆ¿Î◊”∑Ω≥à Ω______________°£
(5)“ª÷÷”…‘™ÀÿW°¢R◊È≥…µƒ∞◊…´πÃêØ∫œŒÔ£¨∆‰µÁ◊” ΩŒ™_______________°£
(6) ‘±»ΩœŒ»∂®–‘£∫X2W_____ X2Q£ª∑–µ„£∫X2W_____ X2Q £®ÃÓ°∞£º°±ªÚ°∞£æ°±£©°£
(7)‘™Àÿ X°¢Y°¢Z°¢W°¢R°¢Q÷–µƒ¡Ω÷÷‘™Àÿø…–Œ≥…‘≠◊”∏ˆ ˝±»Œ™1°√2µƒπ≤º€ªØ∫œŒÔ£¨‘Ú’‚¡Ω÷÷‘™Àÿµƒ‘≠◊”–Ú ˝÷Æ≤Ó≤ªø…ƒÐ «_________°£
A£Æ2 B£Æ4 C£Æ5 D£Æ7
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø÷–—ß µ—È÷–£¨Õ®≥£¿˚”√»ÁÕºÀ˘ 浃◊∞÷√Ω¯––≈Á»™ µ—È£¨¿¥—È÷§∆¯Ãµƒ°∞»ÐΩ‚–‘°±£¨œ¬¡–”–πÿÀµ∑®≤ª’˝»∑µƒ «

A.”√µŒπк”»Î“∫ÃÂ∫Û£¨”…”⁄∆¯Ãµƒ°∞»ÐΩ‚°±£¨ π∆øƒ⁄—π«øºı–°£¨µº÷¬∆øƒ⁄—π«ø–°”⁄Õ‚ΩÁ—π«ø£¨¥”∂¯–Œ≥…≈Á»™
B.—°”√∫œ µƒ»Ð“∫£¨CO2“≤ƒÐ◊ˆ≈Á»™ µ—È
C.HCl°¢NH3∫ÕSO2æ˘ƒÐ”√∏√◊∞÷√◊ˆ≈Á»™ µ—È
D.”√NO2∆¯ÃÂ◊ˆ≈Á»™ µ—È£¨…’∆ø÷–Ω´≥‰¬˙œ°œıÀ·
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø怫˪˘±˚œ©À·ı• «“ª÷÷”√Õæπ„∑∫«“æþ”–’≥–‘µƒ≤ƒ¡œ£¨∆‰∫œ≥…‘≠¿Ì»ÁÕº£∫

“—÷™£∫RCN‘⁄“ª∂®Ãıº˛œ¬£¨∑¢…˙ÀÆΩ‚∑¥”¶£¨∆‰≤˙ŒÔŒ™RCOOH∫ÕNH3°£
œ¬¡–Àµ∑®’˝»∑µƒ «
A.MƒÐ πÀ·–‘∏þ√ÃÀ·ºÿ»Ð“∫Õ …´£¨≤ªƒÐ π‰ÂÀÆÕ …´
B.…œ ˆ∑¥”¶¿ý–Õ «Àıæ€∑¥”¶
C.1molMµƒÀÆΩ‚≤˙ŒÔ◊Ó∂ýœ˚∫ƒ1molNaOH
D.»ÙRŒ™º◊ª˘£¨Nµƒ∆Ωæ˘œý∂‘∑÷◊”÷ ¡øŒ™11100£¨‘Ún£Ω100
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
π˙º —ß–£”≈—° - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com