
【题目】下列各组气态氢化物的稳定性按由强到弱的顺序排列的是
A. HI HCl H2S PH3
B. PH3 H2S HCl HBr
C. HF HCl H2S SiH4
D. NH3 PH3 H2S HCl
科目:高中化学 来源: 题型:
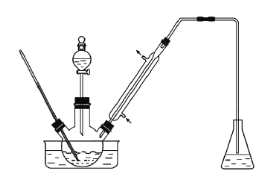
【题目】某化学兴趣小组测定硫铁矿(主要成分FeS2)矿样中硫元素的质量分数,进行如下实验:将m1g样品放入如图所示装置C中,打开K1关闭K2,从a处不断通入空气,高温灼烧石英管中的样品。

请回答下列问题:
(1)装置B的名称为_____;a处不断通入空气的目的是_____。
(2)装置A的作用是_____。
(3)反应结束后,关闭K1打开K2,向烧瓶中加入液体,点燃G处酒精灯,使烧瓶中反应发生,操作流程如图。

①操作I所得溶液中所含的溶质有_____。
②操作Ⅱ是洗涤、烘干、称重,检验固体是否洗净的方法是_____。
③该硫铁矿中硫元素的质量分数为_____(用含m1、m2的代数式表示)
(4)取煅烧后的熔渣(含有Fe2O3、FeO),欲验证其中存在FeO,应选用的试剂是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1) 实验装置中冷凝管的主要作用是___________________。
(2) 步骤1所加入的物质中,有一种物质是催化剂,其化学式为__________________
(3) 写出由苯甲醛制取间溴苯甲醛的化学方程式_____________________________________________________
(4) 为防止污染环境,锥形瓶中盛装的溶液应该是______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+ (aq) + Cu(s) == Cu2+ (aq) + 2Ag (s)设计的原电池如下图。

请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是_____________;
(2)银电极为电池的_________极;银电极上发生的电极反应式______________。
(3)外电路中的电子是从________电极流向______电极(填电极的材料)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是
A. 苯既能发生取代反应,又能发生加成反应
B. 乙烯、甲烷、聚乙烯均可使酸性高锰酸钾溶液褪色
C. 分馏、干馏都是物理变化,裂化、裂解都是化学变化
D. 纤维素、聚乙烯、油脂都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)已知:2NO2(g)= N2O4(g) △H=-55.3kJ/mol
N2O5(g)=2NO2(g)+![]() O2(g) △H=+53.1 kJ/mol
O2(g) △H=+53.1 kJ/mol
则:N2O5(g)=N2O4(g)+![]() O2(g) △H=___________ kJ/mol
O2(g) △H=___________ kJ/mol
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1。若反应中n(NO)︰n(O2)=2︰1,则总反应的化学方程式为___________;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是___________。

(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:

①从0~2s内该反应的平均速率υ(NO)=___________mol/(L·s)。
②T1温度时化学平衡常数K=___________ L/mol。 (结果保留3位有效数字)。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T2___________T1(填“>”、“<”或“=")。
④已知2NO(g)+O2(g)![]() 2NO2的反应历程为:
2NO2的反应历程为:
第一步NO+NO![]() N2O2 快速反应 第二步N2O2+O2→2NO2 慢反应
N2O2 快速反应 第二步N2O2+O2→2NO2 慢反应
下列叙述正确的是___________(填标号)。
A. υ(第一步的正反应)< υ(第二步的反应) B.总反应快慢由第二步决定
C.第二步的活化能比第一步的高 D.第二步中N2O2与O2的碰撞100%有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为:________。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______________。 |
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团:_______________________。 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子。 |
(5)综上所述,A的结构简式_____________。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)![]() N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
温度/℃ | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是
A. 由上述信息可推知:T1 > T2
B. T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质随原子序数的递增呈周期性变化的原因是( )
A. 元素原子的核外电子排布呈周期性变化 B. 元素原子的电子层数呈周期性变化
C. 元素的化合价呈周期性变化 D. 元素原子半径呈周期性变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com