
【题目】在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
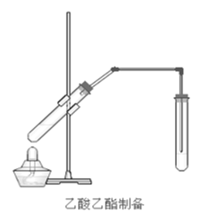
(1)写出制取乙酸乙酯的化学反应方程式________
(2)浓硫酸的作用是:①________;②________。
(3)饱和碳酸钠溶液的主要作用是________、________、________。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中的目的是防止________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是________。
(6)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是________。
【答案】CH3CHOOH+C2H5OH→CH3COOC2H5+H2O 催化剂 吸水剂 除去乙酸 吸收乙醇 降低乙酸乙酯的溶解度,便于析出 倒吸 分液 防止暴沸
【解析】
在浓硫酸做催化剂和吸收剂作用下,乙酸和乙醇共热发生酯化反应生成乙酸乙酯和水,酯化反应是可逆反应,反应中浓硫酸除了起到催化剂的作用外,还起到吸水剂的作用,实验时应加入几块碎瓷片起到防止暴沸的作用,乙酸乙酯中混有乙醇和乙酸,乙酸乙酯不溶于水,乙醇能与水互溶,乙酸具有酸性,能与碳酸钠溶液反应,饱和碳酸钠溶液的主要作用是降低乙酸乙酯的溶解度,便于分层、溶解乙醇杂质、除去乙酸杂质,导管插在饱和碳酸钠溶液的液面下可能发生倒吸,通蒸气的导管要插在饱和碳酸钠溶液的液面上,用分液的方法制得的乙酸乙酯分离出来。
(1)在浓硫酸做催化剂和吸收剂作用下,乙酸和乙醇共热发生酯化反应生成乙酸乙酯和水,反应的化学方程式为CH3CHOOH+C2H5OH![]() CH3COOC2H5+H2O,故答案为:CH3CHOOH+C2H5OH
CH3COOC2H5+H2O,故答案为:CH3CHOOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(2)酯化反应是可逆反应,反应中浓硫酸除了起到催化剂的作用外,还起到吸水剂的作用,使平衡向正反应方向移动,有利于乙酸乙酯的生成,故答案为:催化剂;吸水剂;
(3)乙酸乙酯不溶于水,乙醇能与水互溶,乙酸具有酸性,能与碳酸钠溶液反应,乙酸乙酯中混有乙醇和乙酸,则右边试管内所盛饱和碳酸钠溶液的主要作用是降低乙酸乙酯的溶解度,便于分层、溶解乙醇杂质、除去乙酸杂质,故答案为:除去乙酸;溶解乙醇;降低乙酸乙酯的溶解度,便于析出;
(4)导管不能插入溶液中是因为利用饱和碳酸钠溶液中和挥发出来的乙酸,导管插在饱和碳酸钠溶液的液面下可能发生倒吸,故答案为:防止倒吸;
(5)若要把制得的乙酸乙酯分离出来,应先将盛有混合物的试管充分振荡,使乙酸、乙醇溶解,静置分层后取上层得乙酸乙酯,故答案为:分液;
(6)在给混合液体加热时,加入碎瓷片可以防止暴沸,由于酯化反应的反应物都是液态,所以实验时应加入几块碎瓷片起到防止暴沸的作用,故答案为:防止暴沸。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为______________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为________。
Ⅱ.在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρ g·cm-3,计算该溶液的浓度(用以上字母表示)。
(1)该溶液的物质的量浓度________________
(2)该溶液的质量分数_________________________
Ⅲ.有两份溶液,其中所含溶质相同,设其摩尔质量为M g·mol-1。根据下表信息,回答有关问题:
溶质的质量分数 | 溶液的密度(g·cm-3) | |
第一份溶液 | w1 | ρ1 |
第二份溶液 | w2 | ρ2 |
(1)取等质量两份溶液混合,则所得混合液中溶质的质量分数w3=________。(用以上字母表示)
(2)若有w1>w2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为w4,若ρ1>ρ2,则w3___w4;若ρ1<ρ2,w3______w4(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):
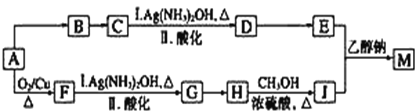
已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;
②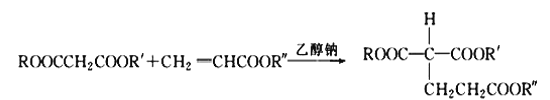 (R、R′、R″代表相同或不相同的烃基)。
(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是_________。
(2)A→B反应所需的试剂是_________。
(3)G→H反应的化学方程式是______。
(4)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(5)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有_______种,其中任意1种的结构简式是__________。
(6)J可合成高分子化合物,该高分子化合物的结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组的同学利用如图所示装置探究二氧化硫气体的性质。请回答:
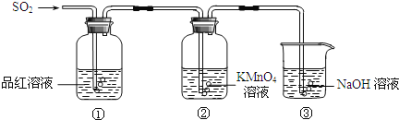
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是____。
(2)当观察到②中溶液颜色变浅时,①中的现象是____。
(3)装置③的作用是___。
(4)①中的现象说明二氧化硫具有的性质是___。
(5)②中的现象说明二氧化硫具有的性质是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2 mol·L-1的NaOH溶液450 mL和0.5 mol·L-1的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
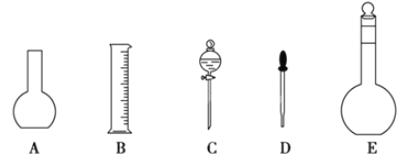
(1)如图所示的仪器中配制溶液肯定不需要的是__(填序号),配制上述溶液还需用到的玻璃仪器是__(填仪器名称)。
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的__(填写序号)。
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是__(用字母表示,每个字母只能用一次)。
A 用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B 准确称取计算好的氢氧化钠固体于烧杯中,再加入少量水(约50 mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C 将容量瓶盖紧,摇匀
D 将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E 改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F 继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(4)根据计算,配制上述NaOH溶液需 NaOH固体的质量为__g。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种同位素X原子的质量数为A,它与2H原子组成2HmX分子,此分子含N个中子,在a g 2HmX中所含电子的物质的量是
A. ![]() (A-N+m) molB.
(A-N+m) molB. ![]() (A-N) mol
(A-N) mol
C. ![]() (A-N+m) molD.
(A-N+m) molD. ![]() (A-N+2m) mol
(A-N+2m) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知,5.6LCH4(标况下数据)与水蒸气完全反应时吸收51.5kJ的热量,请写出该反应的热化学方程式___;
(2)在150℃时2L的密闭容器中,将2molCH4和2molH2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的物质的量浓度变化表示该反应速率v(H2)=___。
②该反应的平衡常数表达式K=___。
③下列选项中能表示该反应已达到平衡状态的是___
A.v(H2)逆=3v(CO)正
B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变
D.c(CH4)=c(CO)
④平衡时容器中CH4的体积分数___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用少量的溴和足量的乙醇制备1,2—二溴乙烷,反应原理为:CH3CH2OH![]() CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:
CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:
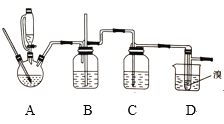
下列说法中不正确的是( )
A. 使用恒压低液漏斗的目的是防止有机物挥发,使漏斗内液体顺利滴下
B. 实验中为了防止有机物大量挥发,应缓慢升高反应温度至170℃
C. 装置C中应加入氢氧化钠溶液,以吸收反应中可能生成的酸性气体
D. 实验过程中应用冷水冷却装置D,以避免溴的大量挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由粗硅制备硅烷(SiH4)的基本流程如图所示:

已知:反应Ⅰ的化学方程式为Si+3HCl= SiHCl3+X,反应Ⅱ的化学方程式为SiHCl3+Y = Si+3HCl(均已配平)。下列说法不正确的是
A.X和Y为同一种物质
B.SiH4的稳定性比NH3强
C.流程中的4个反应有3个属于氧化还原反应
D.反应Ⅳ中SiH4、NH3两种气体在常温常压下体积比为1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com