
【题目】同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体重114g,则某气体的分子量为( )
A.28
B.60
C.32
D.4
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= +49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H= -192.9 kJ·mol-1
下列说法正确的是
A. CH3OH的燃烧热为192.9 kJ·mol-1
B. 反应①中的能量变化如图所示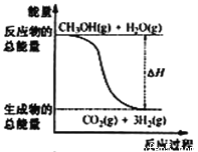
C. CH3OH转变成H2的过程一定要吸收能量
D. 根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有机反应类型:①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤加聚反应 ⑥还原反应 其中可能在有机分子中引入羟基的反应类型是
A.①②③B.①④⑥C.①②⑥D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
I.已知:氰化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,
易水解生成氰化氢。
(1)CN-中C元素显+2价,N元素显-3价,则非金属性N_______C(填“<”“>”或“==”),请设计实验证明:___________________________________________________________________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是________________________________________________________。
I.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【查阅资料】
ⅰ.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合物有沉淀生成。
ⅱ.Na2S2O3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
【实验一】实验室通过如下图所示装置制备Na2S2O3。

(1)实验中要控制SO2生成速率,可采取的措施有____________(写出一条)。
(2))b装置的作用是____________________________。
(3)反应开始后,c中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH溶液”、“水”、“CCl4”中的一种)的注射器,接下来的操作为__________,最后拆除装置。
(5)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____________________________________。若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
①废水中氰化钠的最高排放标准为0.50 mg·L-1;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先于Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(6)滴定时1.000×10-4mol·L-1的标准AgNO3溶液应用_______(填仪器名称)盛装;滴定终点时的现象是_______。
(7)处理后的废水是否达到排放标准:_______ (填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,对于反应N2(g)+3H2(g)![]() 2NH3 (g)△H=-92.4kJ/mol。N2的平衡转化率α(N2)与体系总压强(P)的关系如下图所示。下列说法正确的是:
2NH3 (g)△H=-92.4kJ/mol。N2的平衡转化率α(N2)与体系总压强(P)的关系如下图所示。下列说法正确的是:

A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
B. 上述反应在达到平衡后,增大压强,H2 的转化率提高
C. 平衡状态由A变到B时,平衡常数K(A) < K(B)
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用平衡移动原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅,但比原来要深
B. 高压比常压有利于SO2合成SO3的反应
C. 500 ℃时比室温更利于合成氨
D. 氯水在光照条件下颜色变浅,最终变为无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度时,100 mL 0.01 mol/L的醋酸溶液与10mL 0.l mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A. 中和时所需NaOH的量 B. 与Mg反应的起始速率
C. OH-的物质的量浓度 D. 溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com