
【题目】对三联苯(![]() )是一种有机合成的中间体。下列关于对三联苯的说法中正确的是
)是一种有机合成的中间体。下列关于对三联苯的说法中正确的是
A.对三联苯属于苯的同系物
B.对三联苯分子中至少有16个原子共平面
C.对三联苯的一氯取代物有6种
D.0.2mol对三联苯在足量的氧气中完全燃烧消耗5.1molO2
【答案】B
【解析】
A.对三联苯(![]() )中含有3个苯环,与苯的结构不相似,所以不属于苯的同系物,错误;
)中含有3个苯环,与苯的结构不相似,所以不属于苯的同系物,错误;
B.因为苯环是平面正六边型结构,与苯环直接相连的原子一定在同一平面内,则所有原子可能共面,若将苯环围绕连接苯环的碳碳键转动,则有部分原子会不在同一平面,但是无论怎样转动,至少共平面的原子数为:11+1+1+1+2=16个,正确;
C.对三联苯的结构对称,从中间看,共有4种位置的H元素,则对三联苯的一氯取代物有4种,错误;
D.对三联苯的分子式为C18H14,1mol该物质燃烧消耗氧气为:18mol+14/4mol=21.5mol,0.2mol对三联苯在足量的氧气中完全燃烧消耗0.2mol×21.5=4.3molO2,错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是恒温条件下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )

A.反应达到平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.10 mol/L的NaOH溶液分别滴定体积均为20.00mL、浓度均为0.050 mol/L的盐酸、磷酸及谷氨酸(H2G),滴定曲线如图所示:
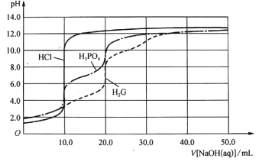
下列说法正确的是
A.滴定盐酸时,用甲基橙作指示剂比用酚酞更好
B.H3PO4与H2G的第一电离平衡常数K1的数量级不同
C.用酚酞作指示剂滴定磷酸到终点时,溶液中的溶质为Na2HPO4
D.NaH2PO4溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计不合理的是
A. 自制“84”消毒液
自制“84”消毒液
B.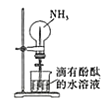 利用喷泉实验探究NH3的部分性质
利用喷泉实验探究NH3的部分性质
C. 制备Fe(OH)2白色沉淀
制备Fe(OH)2白色沉淀
D.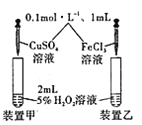 探究不同催化剂对双氧水分解速率的影响
探究不同催化剂对双氧水分解速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定意义重大,氮肥的使用大面积提高了粮食产量。人工固氮最有效的方法是合成氦,一种工业合成氨的简易流程如图所示(净化、后期处理等流程未列出):

回答下列问题:
Ⅰ.步骤A制氢气的原理之一是CH4(g)+2H2O(g)CO2(g)+4H2(g) H=a kJ/mol
(1)已知:H2、CH4的燃烧热分别为285.8kJ/mol、890.31k/mol;H2O(g)H2O(l) H=-44kJ/mol则a=____kJ/mol。
(2)在密闭容器中,既能加快反应速率,又一定能提高平衡体系中H2体积分数的措施是_____(填序号)。
a.加入催化剂 b.升高温度 c.降低压强 d.增大c(H2O)
Ⅱ.步骤B完成了原料气准备后,通过步骤C合成氨,其原理为N2(g)+3H2(g)![]() 2NH3(g) H=-92.4kJ/mol。
2NH3(g) H=-92.4kJ/mol。
(3)若T℃下,向一个容积为2L的真空密闭容器中(有催化剂)通入lmol N2、3mol H2,1分钟后达到化学平衡状态,测得容器内的压强是开始时的0.8倍。则:
①下列叙述可说明该反应已经达到化学平衡状态的是______(填序号)。
a.3v(H2)正=2v(NH3)逆 b.混合气体的平均相对分子质量不再发生改变
c.混合气体的密度不再发生改变 d. 1个N≡N键断裂的同时有3个H—H键生成
②t分钟内v(H2)=_______。
③T℃下该反应的K=___________(列出计算式即可)。
④一定条件下,向体积相同的甲(含催化剂)、乙两个容器中分别充入等物质的量的N2和等物质的量的H2进行合成氨反应,均反应1小时、测得N2的转化率随温度变化如图所示,a、b、c三点中达到化学平衡状态的点有_________,乙装置中N2转化率随着温度的升高先升后降的原因可能是______。

(4)我国科学家成功研制出一种高效电催化固氮催化剂Mo2N,其固氮原理如图所示,该装置中,阴极上的电极反应式为______。
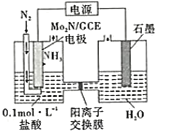
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)环戊二烯分子中最多有__个原子共平面。
(2)金刚烷的分子式为__,其二氯代物有_种。
(3)已知烯烃能发生如下反应:
 。
。
请写出下列反应产物的结构简式:![]()
![]() __。
__。
(4)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基,写出A所有可能的结构简式不考虑立体异构:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃)。某苯甲酸晶体 中含少量可溶性杂质X和难溶性杂质Y。现拟用下列装置和操作进行提纯:装置:
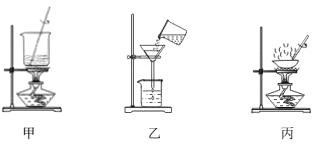
操作:①常温过滤②趁热过滤③加热溶解④结晶⑤洗涤、干燥下列有关说法正确的是_________
A.用甲装置溶解样品,X 在第①步被分离
B.用乙装置趁热过滤,Y 在第②步被分离
C.用丙装置所示的方法结晶
D.正确的操作顺序为:③→④→②→①→⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物在现代工业、农业生产中有着广泛的应用,同时也是实验室中常用的重要试剂。
(1)KMnO4是强氧化剂,其溶液中c(H+)=c(OH-),则常温下0.01molL-1的HMnO4溶液的pH=_____________。
(2)MnS常用于除去污水中的Pb2+等重金属离子:Pb2+(aq)+ MnS(s)PbS(s)+Mn2+(aq),若经过处理后的水中c(Mn2+)=1 ×10-6 molL-1,则c(Pb2+)=______________[已知Ksp(PbS)=8×10-28、Ksp(MnS)=2×10-13]。
(3)锰是农作物生长的重要微量元素,用硫酸锰溶液拌种可使农作物产量提高10%~15%。某工厂利用回收的废旧锌锰干电池生成硫酸锰晶体(MnSO4H2O)的流程如图所示:
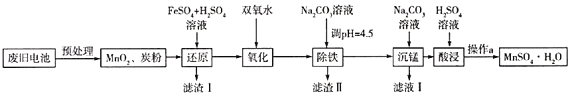
①MnSO4中含有的化学键类型有_______________。
②滤渣Ⅱ的主要成分是____________,滤渣Ⅰ是一种黑色单质,“还原”过程中氧化产物是Fe3+,写出相应反应的离子方程式_________,此反应中MnO2的转化率与温度之间的关系如图所示,则适宜的温度是______________(填字母)。
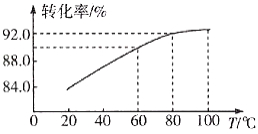
a.40 ℃ b.60 ℃ c.80 ℃ d.100 ℃
③“沉锰”中有无色无味的气体生成,还有MnCO36Mn(OH)25H2O生成,写出相应反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品,通过盛有足量I2O5的干燥管,在170 ℃下充分反应;
②用水-乙醇混合溶液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________。(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)。
(4)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com